
Кипение и замерзание, осмотическое давление – это коллигативные свойства растворов. Они определяются только количеством растворенных частиц в единице объема и совсем не зависят от природы раствора.
Содержание:
- Раствор и чистое вещество: в чем разница
- Почему жидкость вообще кипит (замерзает)?
- Кипение и замерзание растворов: основные понятия
- Закон Рауля для кипения и замерзания растворов
- Кипение и замерзание растворов: примеры вычислений
Раствор и чистое вещество: в чем разница
Раствор представляет собой совокупность как минимум двух веществ, равномерно распределенных друг в друге.
Если состав конкретного вещества является постоянным, то состав раствора может меняться в широких пределах. Отсюда понятие концентрации раствора.
Если чистое жидкое вещество кипит (или замерзает) при строго определенной температуре, то раствор – в диапазоне температур, который будет определяться его концентрацией.
Как пример – замерзание морской воды. У берега, где в море впадают ручьи, мелкие речушки и большие реки, пресная и морская вода перемешиваются. Следовательно, здесь концентрация солей значительно меньше, чем вдали от берега, в открытом море. Поэтому если у берега морская вода замерзнет, то в открытом море льда при тех же условиях можно не обнаружить.

Почему жидкость вообще кипит (замерзает)?
Представим сосуд, в котором находится дистиллированная вода.
Некоторые молекулы воды отрываются от поверхностного слоя и переходят в пространство над ним, образуя пар. Насыщаясь, пар начинает оказывать определенное давление, которое называется давлением насыщенного пара над жидкостью.
Когда давление пара сравняется с нормальным давлением (101,3 кПа), вода закипит. И станет это возможным только в том случае, если температура ее достигнет 100 ℃. Именно при этих условиях от поверхности будет отрываться достаточное количество молекул воды, чтобы образовать над ней пар.
Теперь представим, что в воде растворили некоторое количество какого-либо вещества (сахароза, хлорид натрия и т.д.). В таком случае с поверхности раствора до момента его закипания будет отрываться меньшее количество молекул воды, потому что часть поверхности занята частицами растворенного вещества. (Именно поэтому, кстати, поверхностное натяжение чистой воды и раствора будут отличаться.) Чтобы раствор закипел, то есть чтобы давление пара стало равным 101,3 кПа, придется его нагреть до температуры более 100 ℃ (см. рисунок ниже).
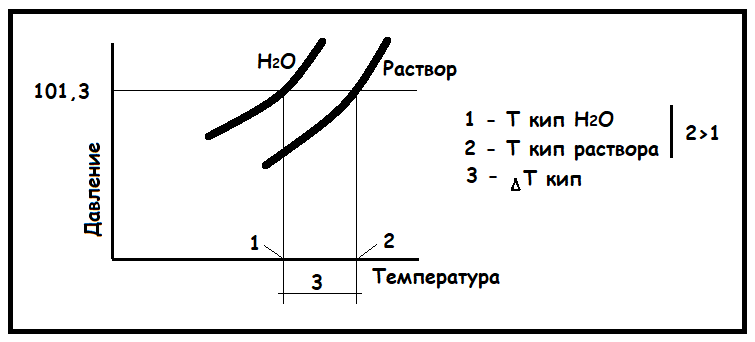
Таким образом, температура кипения раствора отличается от температуры кипения чистого растворителя: она всегда выше. Отсюда, чем выше концентрация растворенного вещества, тем выше температура кипения раствора.
Точно так же можно объяснить и понижение температуры замерзания (кристаллизации) раствора по сравнению с чистым растворителем. Температура замерзания раствора ниже температуры замерзания чистого растворителя. И чем выше концентрация растворенного вещества, тем ниже температура замерзания раствора.
Оба процесса: и повышение температуры кипения раствора, и понижение температуры его замерзания, – подчиняются принципу Ле Шателье, то есть это равновесные процессы.
Кипение и замерзание растворов: основные понятия
Температура кипения жидкости (tкип) – температура, при которой давление ее насыщенного пара равно величине внешнего давления.
Температура замерзания жидкости (tзам) – это температура, при которой жидкость меняет свое агрегатное состояние, переходя из жидкого состояния в твердое.
Повышение температуры кипения (Δtкип) – разность между температурами кипения раствора и чистого растворителя:
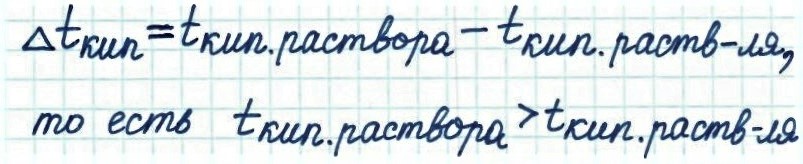
Понижение температуры замерзания (Δ tзам) – разность между температурами замерзания чистого растворителя и раствора:

Закон Рауля для кипения и замерзания растворов
Ф.М. Рауль (1886 г.) обратил внимание, что для разбавленных растворов неэлектролитов повышение температуры кипения и понижение температуры замерзания пропорциональны концентрации раствора.
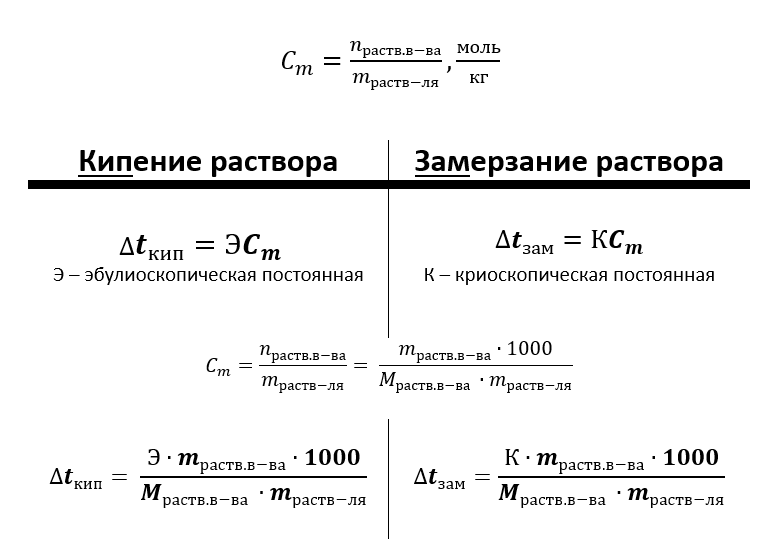
Эбулиоскопическая и криоскопическая постоянные:
- не зависят от природы растворенного вещества;
- определяются природой растворителя;
- индивидуальны для каждого отдельного растворителя.
Таблицу эбулиоскопических и криоскопических постоянных можно найти здесь.
Кипение и замерзание растворов: примеры вычислений
Пример 1. 10 г сахарозы растворили в 200 г воды. При каких температурах кипит и замерзает этот раствор (давление атмосферное)?
В данном примере вода – растворитель, сахароза – растворенное вещество.


Измерив температуру кипения (или замерзания) раствора, можно определить молекулярную массу растворенного вещества.
Пример 2. Какова молекулярная масса вещества, если температура замерзания раствора, содержащего 100 г бензола и 0,2 г исследуемого вещества на 0,17К ниже температуры замерзания бензола (К=5,16).

Используя закон Рауля для кипения и замерзания растворов, возможно не только определить молекулярную массу вещества, но и вычислить его молекулярную формулу.
Пример 3. В 100 г воды растворено 12 г двухатомного спирта. Опытным путем установлено, что температура кристаллизации раствора -3,6℃. Каковы молекулярная масса и молекулярная формула вещества?


кипение и замерзание растворов
Подробнее о молекулярной массе здесь, о вычислении молекулярной формулы здесь.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
 ХИМИЯ ДЛЯ ЧАЙНИКОВ
ХИМИЯ ДЛЯ ЧАЙНИКОВ 

