
Кривая титрования строится в объемном (титриметрическом) анализе вещества.
В зависимости от вида титрования (кислотно-основное, потенциометрическое, амперометрическое и т.д.) она может принимать самый различный вид. Основной принцип построения кривых титрования разберем на примере кислотно-основного титрования.
Для чего вообще необходимо строить эту кривую? В данном случае это делают, чтобы верно подобрать индикатор, который позволит наглядно оценить ход титрования, а также вычислить погрешность этого процесса.
Содержание
Кривая титрования и ее основные составляющие
Основные процессы кислотно-основного титрования
Построение кривой кислотно-основного титрования
КРИВАЯ ТИТРОВАНИЯ И ЕЕ ОСНОВНЫЕ СОСТАВЛЯЮЩИЕ
Кривая титрования – это своего рода графическое изображение процесса титрования. Она показывает, как зависит связанный с концентрацией титруемого вещества или титранта выбранный параметр системы от изменения состава раствора в ходе титрования.
Дадим определения, связанные с кривой титрования, и укажем ее основные составляющие.
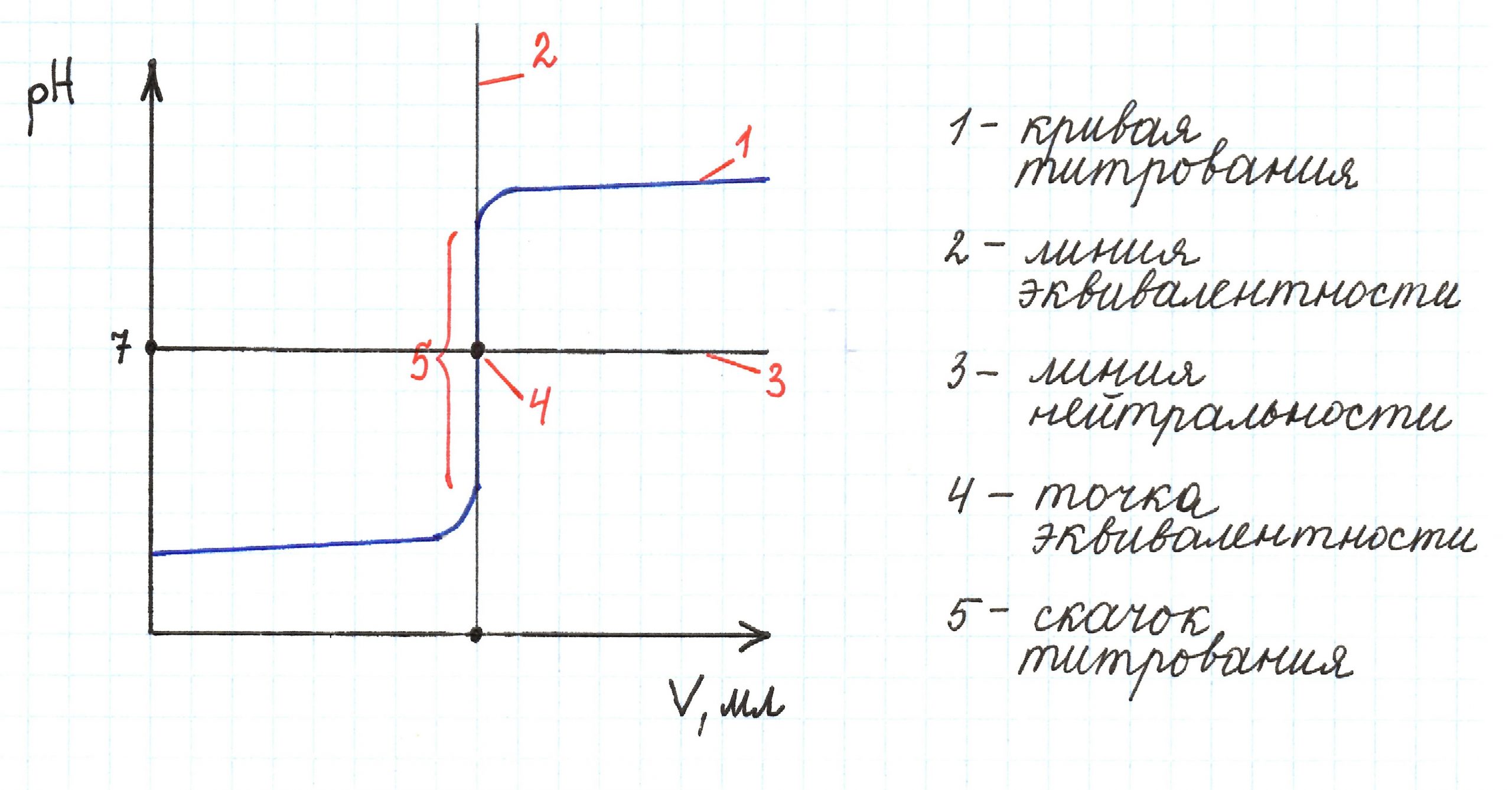
Скачок титрования – интервал, в котором резко изменяется рН около точки эквивалентности.
Линия нейтральности – прямая, соответствующая pH 7,0 и параллельная оси абсцисс.
Линия эквивалентности – прямая, соответствующая эквивалентному объему титранта и параллельная оси ординат.
Точка эквивалентности – момент титрования, когда прибавляемое растворенное вещество полностью прореагировало с растворенным веществом, находящимся в анализируемом (титруемом) растворе.
ОСНОВНЫЕ ПРОЦЕССЫ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
Существует два основных метода кислотно-основного титрования: ацидиметрия и алкалиметрия.
В случае алкалиметрии титрантом является раствор щелочи. Пусть это будет гидроксид натрия NaOH.

В ходе титрования находящийся в бюретке титрант (прозрачный раствор щелочи) по каплям добавляется к прозрачному раствору соляной кислоты, находящейся в колбе-приемнике.
В колбе происходит взаимодействие между кислотой и щелочью – реакция нейтрализации, приводящая к образованию соли NaCl, которая не подвергается гидролизу:
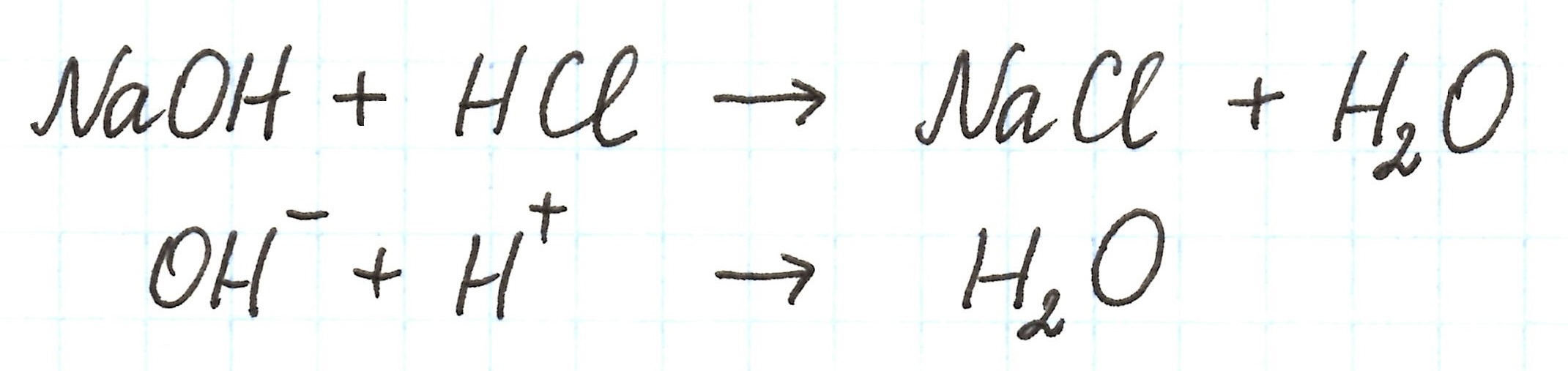
Таким образом, процесс сводится к образованию молекул воды.
Титрование складывается из нескольких этапов, по которым и строят кривую.

В точке эквивалентности титрование (то есть постепенное приливание титранта) прекращают. Но как визуально определить этот момент, если реагируют два прозрачных вещества и образуется опять-таки прозрачное вещество?
Нужен индикатор. В кислотно-основном титровании используются индикаторы двух видов: кислотные и основные. Они меняют свой цвет в определенном промежутке рН, в пределах которого есть момент, когда окраска изменяется наиболее резко. Этот момент наступает при конкретном значении рН, которое называется показателем титрования рТ.
При подборе индикатора очень важно, чтобы значение его рТ находилось как можно ближе к точке эквивалентности и лежало на участке скачка титрования. Может оказаться, что таких индикаторов будет несколько.
ПОСТРОЕНИЕ КРИВОЙ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
Применяют раствор щелочи (NaOH, KOH) для титрования раствора сильной кислоты (например, HCl) или раствора слабой кислоты (например, CH3COOH). В обоих случаях внешний вид кривой будет несколько отличаться. Иным будет и внешний вид кривой в случае с многоосновной кислотой (например, H3PO4).
Задание. Построить кривую титрования 20 мл (0,02л) раствора соляной кислоты (С=0,1н.) раствором гидроксида натрия (С=0,1н.)
Введем обозначения:
Ск – концентрация кислоты, н.;
Сосн – концентрация основания, н.;
Vк – объем кислоты, л;
Vосн – объем основания, л;
Vобщ – общий объем раствора в колбе (Vобщ= Vк + Vосн), л;
КН2О – ионное произведение воды (КН2О = 10-14).
Водородный показатель считаем по формуле: pH = -lg[H+].
Записи и расчеты будем вести в виде таблицы. Основные расчетные формулы, а также точки, по которым будем строить кривую: добавленный объем щелочи (мл) и рН раствора в колбе-приемнике, – обозначим красным цветом.
Итак, первый этап построения кривой титрования («до начала титрования»), когда в колбе-приемнике нет ни капли щелочи. Концентрация ионов водорода H+ соответствует концентрации кислоты, так как HCl → H+ + Cl— (при диссоциации 1 моля кислоты образуется 1 моль ионов H+).

Второй этап построения кривой титрования («до точки эквивалентности»), когда в колбе-приемнике происходит нейтрализация лишь части кислоты.
Учтем, что взаимодействие NaOH и HCl с одинаковыми концентрациями происходит в эквивалентных количествах (см.уравнение реакции выше). Значит, на 20 мл 0,1н. кислоты HCl будет приходиться 20 мл 0,1н. щелочи NaOH. Таким образом, 10 мл добавленной NaOH – это 50% всей требуемой для нейтрализации щелочи. В последующих расчетах рассуждаем аналогично.
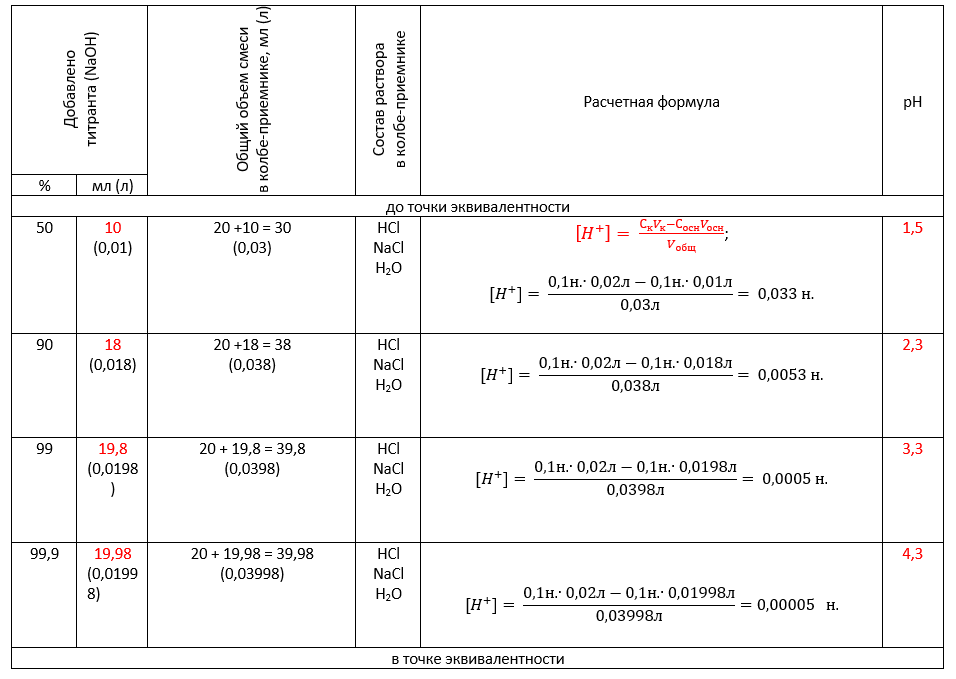
«В точке эквивалентности» происходит полная нейтрализация кислоты щелочью, образуется хлорид натрия NaCl, не подвергающийся гидролизу. Именно поэтому концентрацию ионов Н+ водорода рассчитываем как квадратный корень из ионного произведения воды:
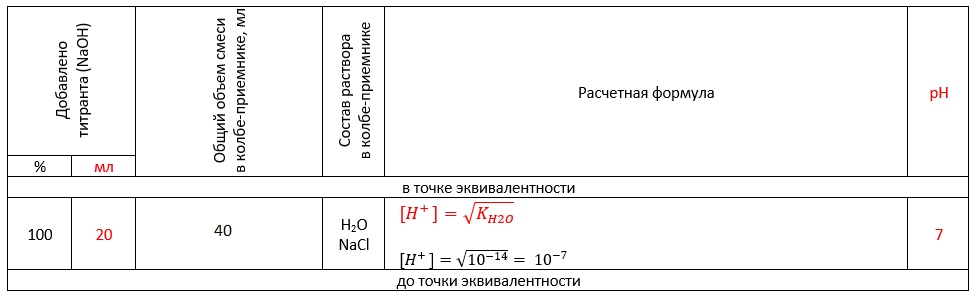
«После точки эквивалентности» добавляем к нейтральному раствору избыток щелочи. В растворе в таком случае присутствуют H2O, NaCl (в виде ионов Na+ и Cl—) и NaOH (в виде ионов Na+ и OH—).
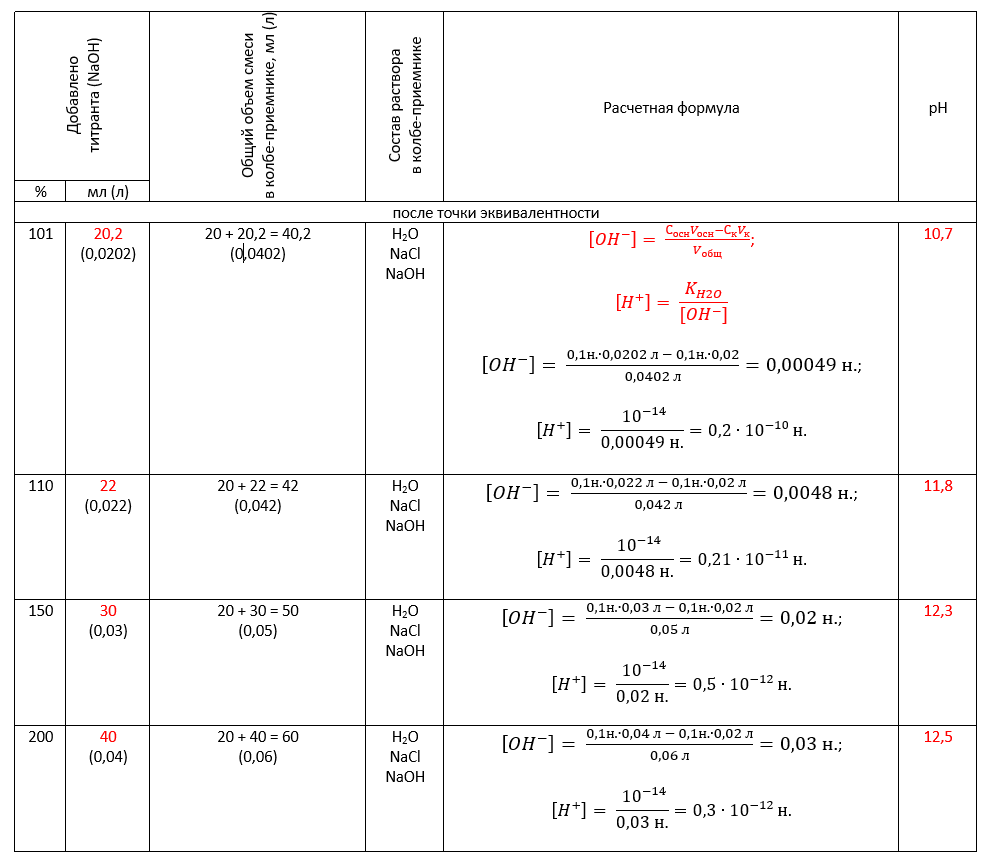 Для наглядности объединим все необходимые числа в одну таблицу:
Для наглядности объединим все необходимые числа в одну таблицу:

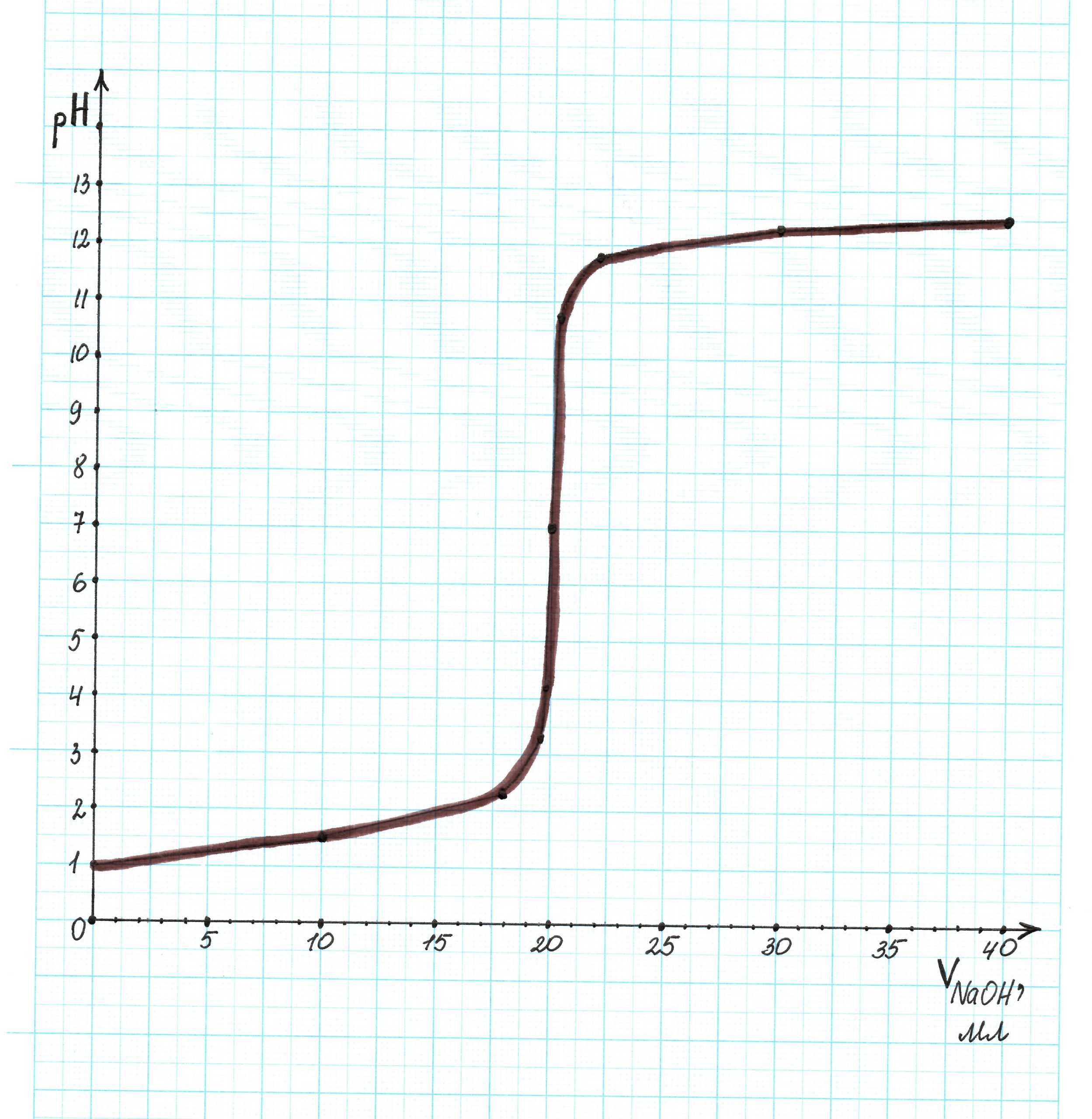
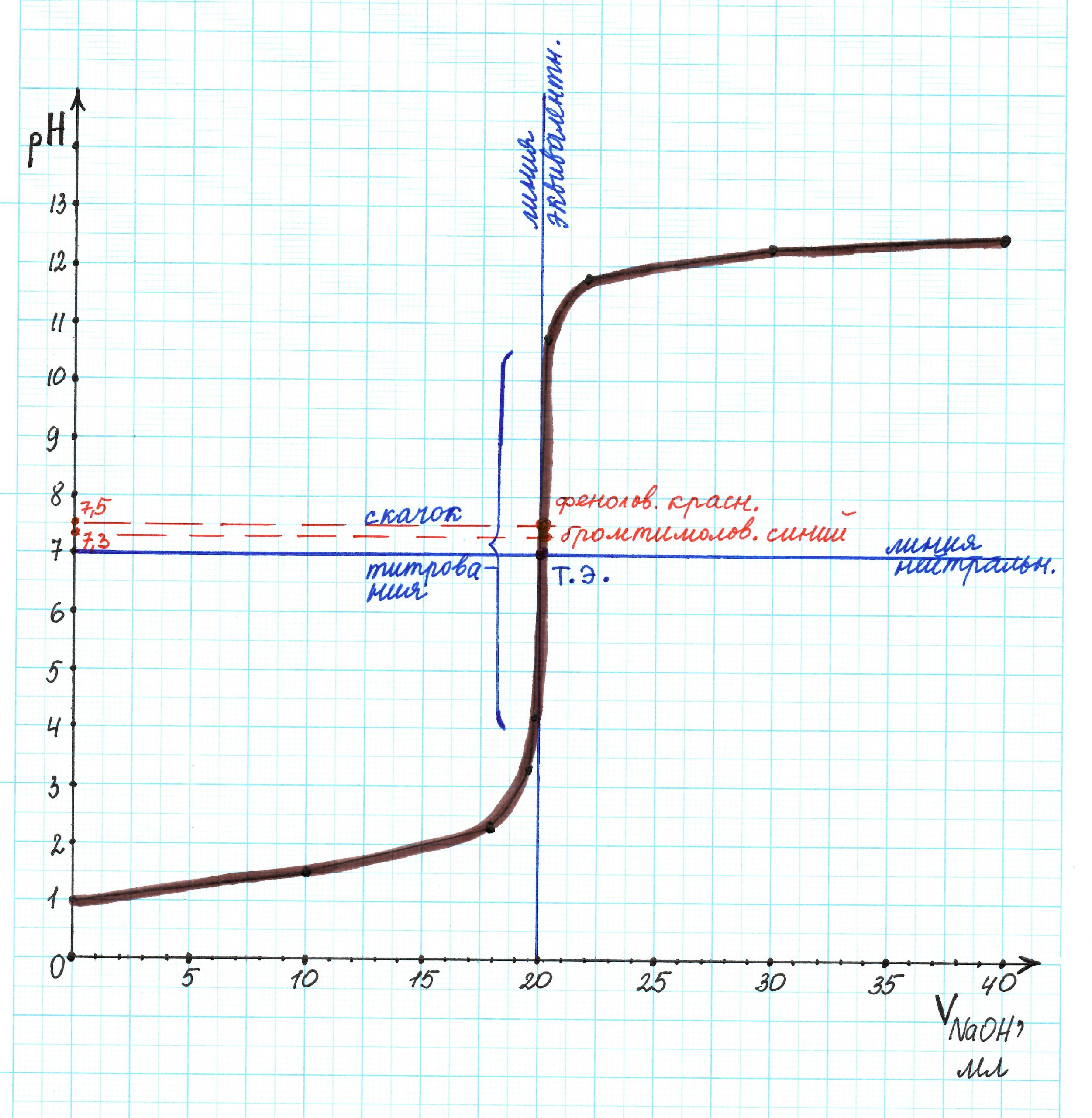
На основании полученных данных построим кривую титрования:
Покажем все линии и скачок титрования:
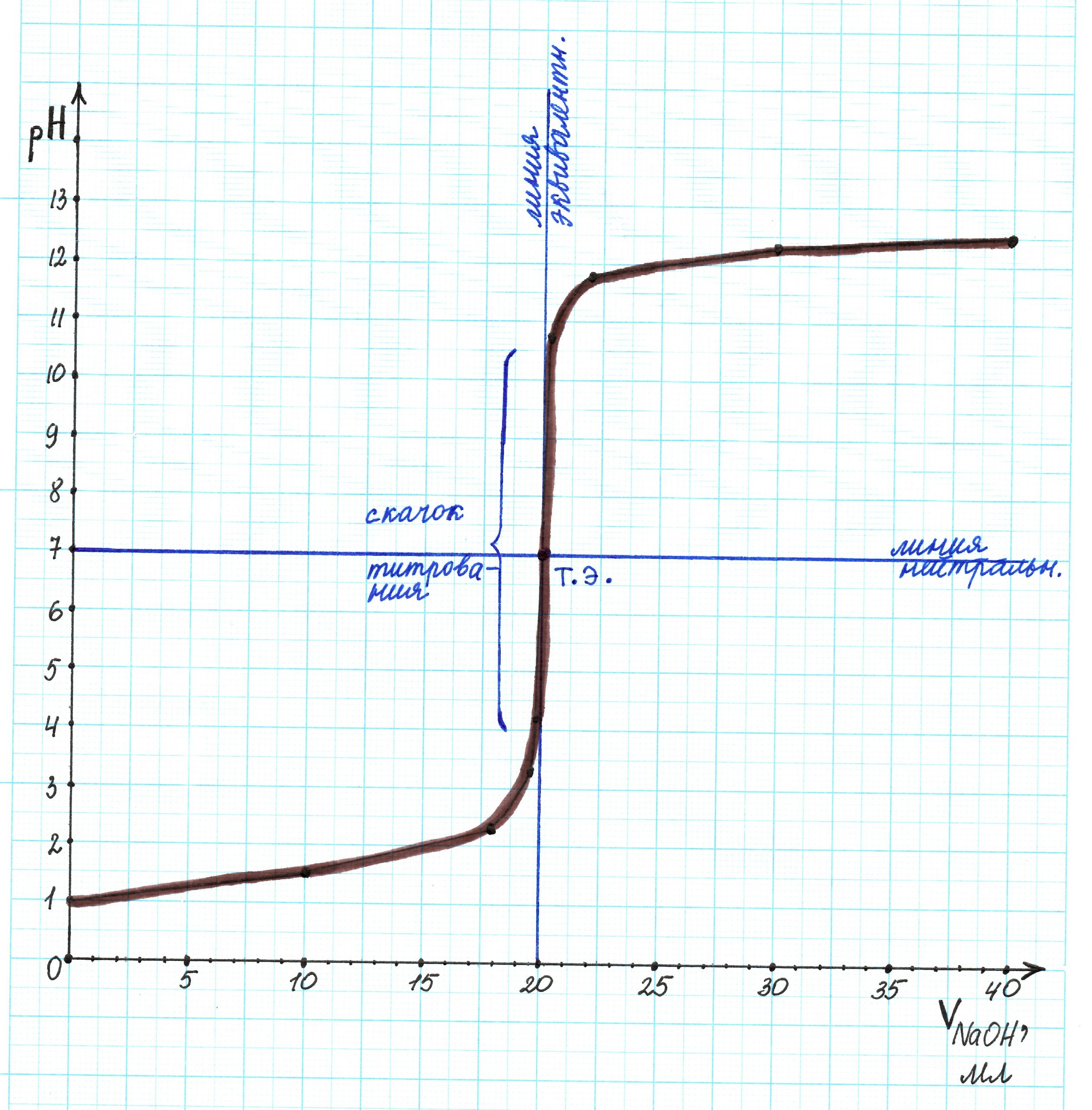
Проанализируем полученную кривую:
— линия нейтральности и прямя рН 7 совпадают;
— точка эквивалентности находится в значении рН 7;
— линия эквивалентности совпадает с прямой 20 мл;
— скачок титрования соответствует интервалу рН 3,3…10,7.
ВЫБОР ПОДХОДЯЩЕГО ИНДИКАТОРА
При выборе индикатора важно, чтобы его показатель титрования рТ был как можно ближе к точке эквивалентности. Наиболее часто используются следующие кислотно-основные индикаторы:
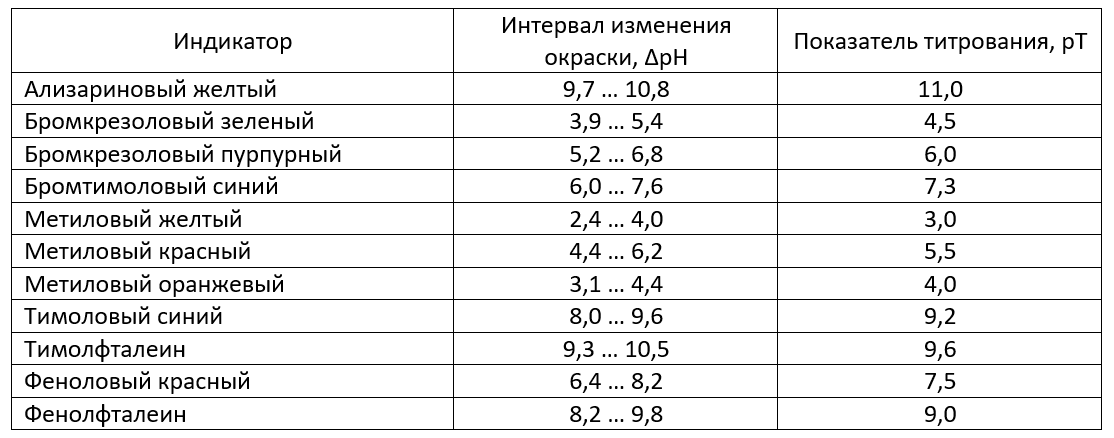 Проанализируем рТ индикаторов, расположенных в таблице. Выберем два наиболее подходящих.
Проанализируем рТ индикаторов, расположенных в таблице. Выберем два наиболее подходящих.
Таковыми оказались бромтимоловый синий рТ 7,3 (интервал изменения окраски ∆рН = 6,0 … 7,6) и феноловый красный рТ 7,5 (интервал изменения окраски ∆рН = 6,4 … 8,2). Их показатели титрования ближе всего к точке эквивалентности, а интервал изменения окраски проходит через нее.
При выборе индикатора следует учесть ошибку, которая может возникнуть из-за того, что рТ не совпадает с рН в точке эквивалентности.
И действительно, рН в точке эквивалентности в нашем случае равен 7. Показатель титрования бромтимолового синего составляет 7,3, а фенолового красного – 7,5. Это не совпадает с рН в точке эквивалентности, хотя и очень близко к ней. Такие значения рТ индикаторов говорят о наличии некоторого избыточного количества гидроксид-ионов в растворе.
Кривая титрования может быть построена с помощь приложения Excel.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
 ХИМИЯ ДЛЯ ЧАЙНИКОВ
ХИМИЯ ДЛЯ ЧАЙНИКОВ 

