
Выход реакции в реальных условиях, т.е. на практике, всегда оказывается меньше рассчитанного теоретически. Постоянно вмешиваются какие-либо факторы, снижающие ожидаемое количество продукта: протекание побочных реакций, частичная обратимость процесса т.д.
Запомните: практический выход продукта реакции всегда меньше теоретического!
Обычно в условии задачи говорится о том, что из какой-то массы m (или V, или n) исходного вещества А образовалась какая-то масса (или V, или n) конечного продукта В. Главное слово здесь — «образовалась». Это значит, что реально, практически была получена данная масса (или V, или n) вещества В.
А сколько можно было бы получить на самом деле вещества В, то есть теоретически? Для этого необходимо произвести обычный расчет по уравнению реакции и найти массу m (или V, или n) вещества В.
Ну, а затем перейти к нахождению выхода продукта реакции ƞ, используя основную расчетную формулу:

Возможны и обратные задачи, когда, зная практический выход продукта, необходимо найти количество исходного вещества.
Пример 1. При пропускании сероводорода объемом 2,8 л (нормальные условия) через избыток раствора сульфата меди (II) образовался осадок массой 11,4 г. Определите выход продукта реакции.
Проанализируем условие задачи. При взаимодействии сероводорода с сульфатом меди (II) выпадет осадок сульфида меди (II) CuS массой 11,4 г. Это количество осадка, которое получилось практически. Для расчета выхода продукта реакции потребуется определить массу осадка, которая могла быть получена теоретически. Расчет проводим, используя уравнение реакции.

выход продукта реакции
Пример 2. Какой объем оксида серы (IV) надо взять для реакции окисления кислородом, чтобы получить оксид серы (VI) массой 20 г, если выход продукта равен 80%? Объем рассчитайте при нормальных условиях.
В предложенной задаче практический выход продукта реакции (SO3) известен. Для расчета объема исходного вещества (SO2) воспользуемся уравнением реакции. Предварительно вычислим то количество оксида серы (VI), которое должно быть получено теоретически.

Пример 3. Природный газ объемом 240 л (нормальные условия) использовали для получения ацетилена. Объемная доля метана в газе составляет 85%. Определите объем образовавшегося ацетилена, приведенный к нормальным условиям, если его выход составил 60%.
Эта задача подобна предыдущей. Ее условие несколько усложнено. Известен не объем исходного вещества, а его доля в газообразной смеси (в природном газе). Поэтому прежде, чем начать расчеты по уравнению реакции, необходимо вычислить объем метана, из которого будет получен ацетилен.
выход продукта реакции

Пример 4. При взаимодействии 184 г толуола с 472,5 г азотной кислоты получено 400 г тринитротолуола. Вычислить массовую долю выхода тринитротолуола от теоретически возможного.
В этой задаче также есть некоторое усложнение условия. Сказано, что в реакцию вступают 2 вещества: толуол и азотная кислота. Известны их массы. Подобное означает, что какое-то из исходных веществ может быть израсходовано не до конца. Следовательно, сначала потребуется определить, какое из веществ взято в избытке, а какое в недостатке. Все последующие расчеты будем вести по недостатку, поскольку вещество, взятое в недостаточном количестве, в ходе реакции израсходуется полностью.

выход продукта реакции
Приведем еще несколько задач на вычисление выхода реакции.
Пример 5. Какой объем природного газа, который содержит метан (объемная доля 96%), азот, благородные газы, оксиды углерода и незначительные количества примесей, потребуется для получения водорода, при помощи которого можно восстановить оксид молибдена (VI) массой 14,4 кг? Водород получают конверсией природного газа с водяным паром. Выход водорода составляет 80%. Объем рассчитайте при нормальных условиях.
Здесь речь идет о двух взаимосвязанных химических процессах. Реакцию конверсии метана обозначим (1), реакцию восстановления оксида молибдена (VI) водородом – (2).
Еще одной особенностью являются единицы измерения. Приведем их в соответствие с условием задачи, умножив на 1000 (кило-): моль → кмоль, л → м3, г/моль → кг/кмоль, л/моль → м3/кмоль.

выход продукта реакции
Пример 6. При дегидрировании этана объемом 89,6 л (нормальные условия) с выходом 80% получили этилен. Какой объем растворителя 1,2-дихлорэтана может быть получен из этого этилена? Плотность 1,2-дихлорэтана принять равной 1,24 г/мл.

выход продукта реакции
Пример 7. Кислородсодержащее органическое соединение Х, получаемое при гидролизе жиров, реагирует с гидроксидом меди (II), образуя вещество ярко-синего цвета. Соединение Х может быть получено также при каталитическом окислении пропилена. К образцу вещества Х добавили избыток натрия, собрав с выходом 70% водорода объемом 4,704 л (нормальные условия). Какая масса пропилена потребуется для получения данного образца вещества Х, если выход продукта при каталитическом окислении составляет 80%? Назовите соединение Х.
При гидролизе жиров образуется трехатомный спирт глицерин и смесь одноосновных карбоновых кислот.
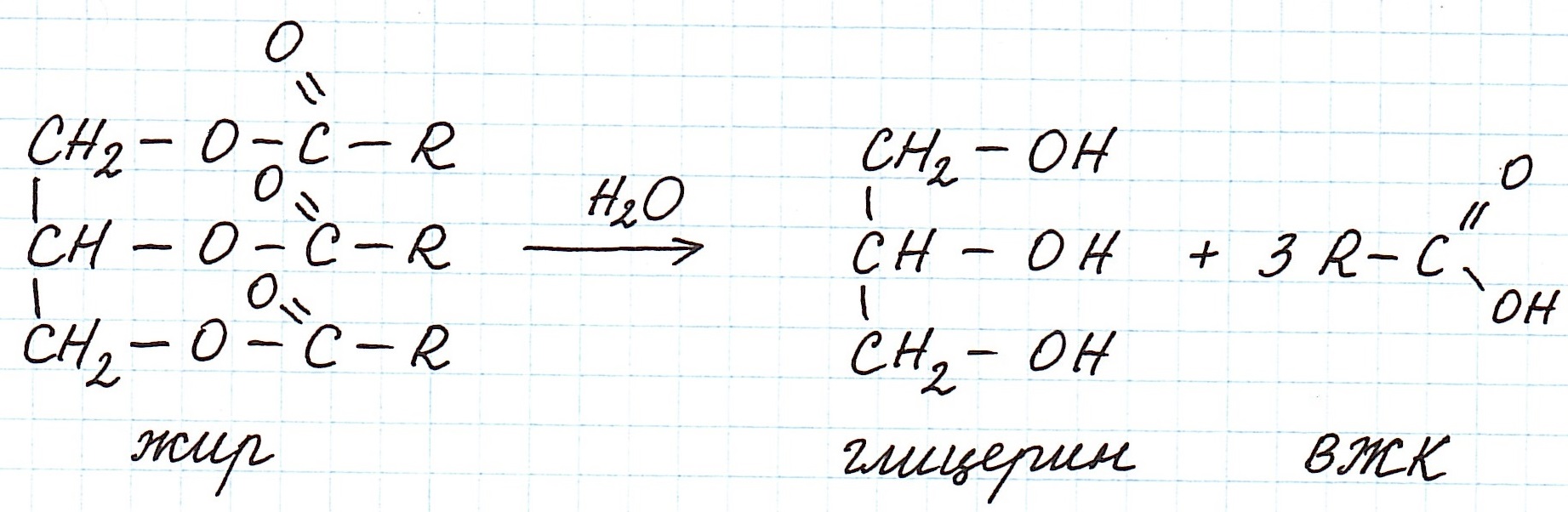
Именно глицерин прореагирует с осадком гидроксида меди (II), растворяя его и образуя вещество ярко-синего цвета. Это качественная реакция на многоатомные спирты.
Кроме того глицерин, действительно, может быть получен путем каталитического окисления пропилена. Правда, реакция идет не напрямую, а через несколько промежуточных продуктов:
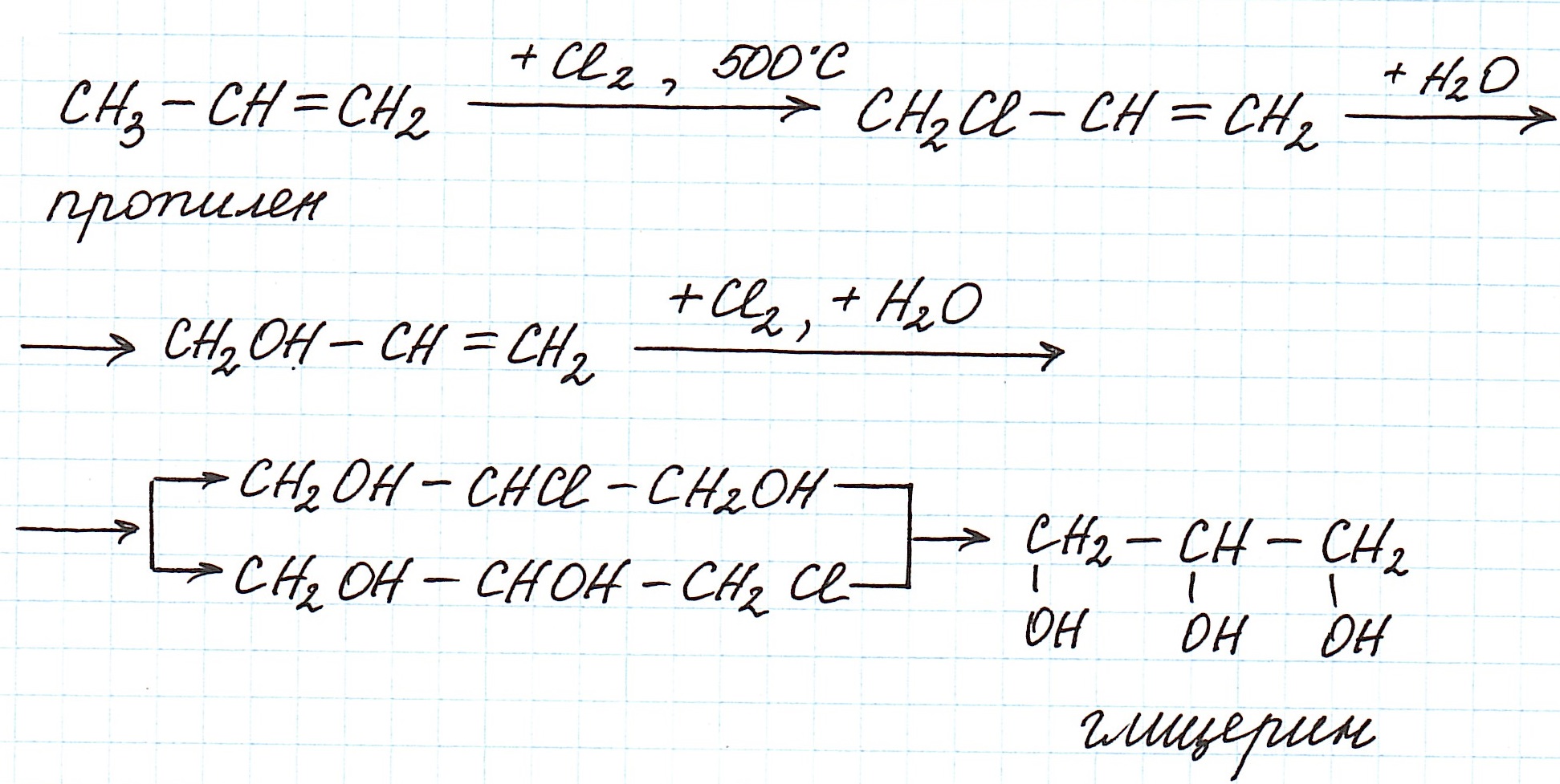
В предложенной задаче выход продукта указывается на каждой из стадий процесса: от получения глицерина (реакция (1)) до выделившегося водорода (реакция (2)).
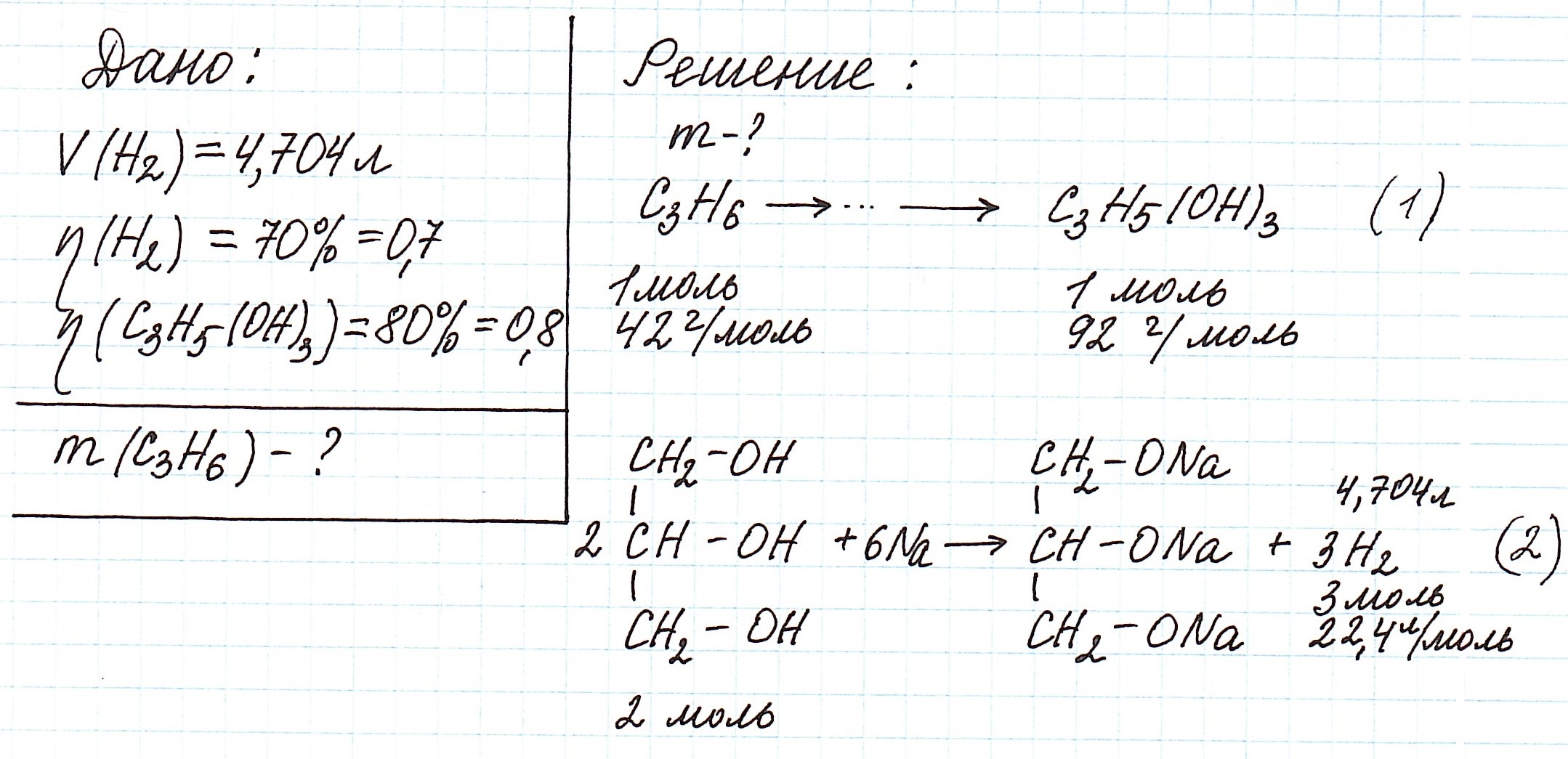
Используя расчеты по уравнению реакции (2), определим количество вещества водорода, которое могло бы выделиться при 100% выходе:
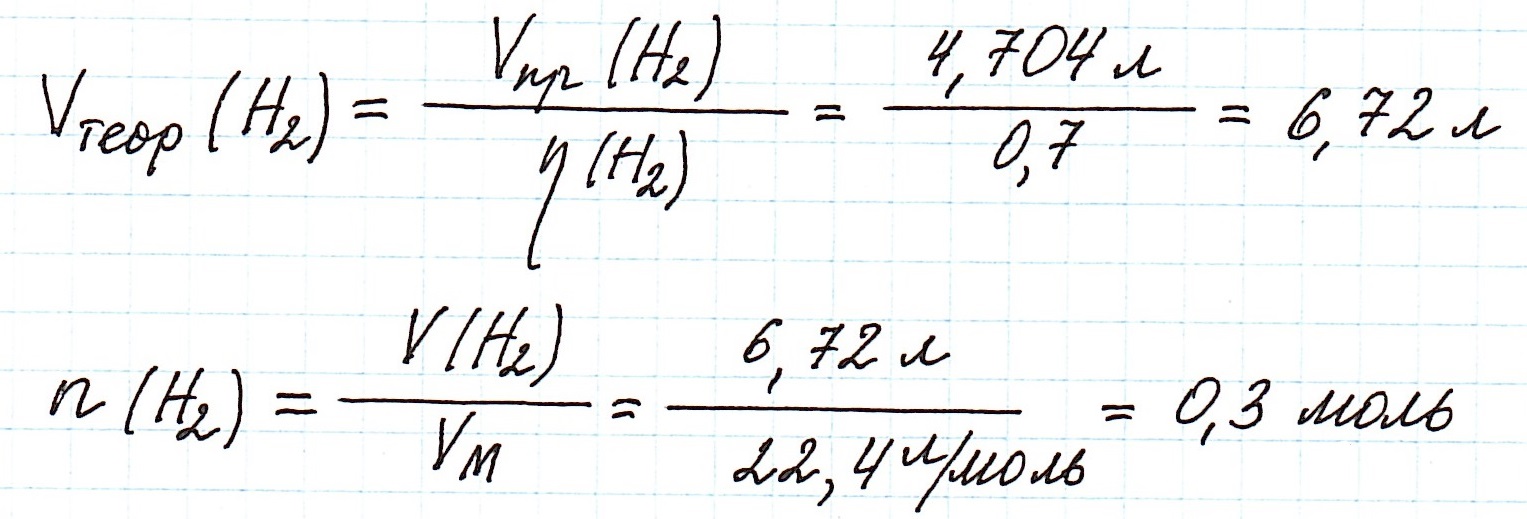
Из реакции (2) также вычислим количество глицерина, которое вступило в реакцию с натрием. Для реакции (1) это количество глицерина будет ее практическим выходом. Далее определим, сколько глицерина можно было получить теоретически: 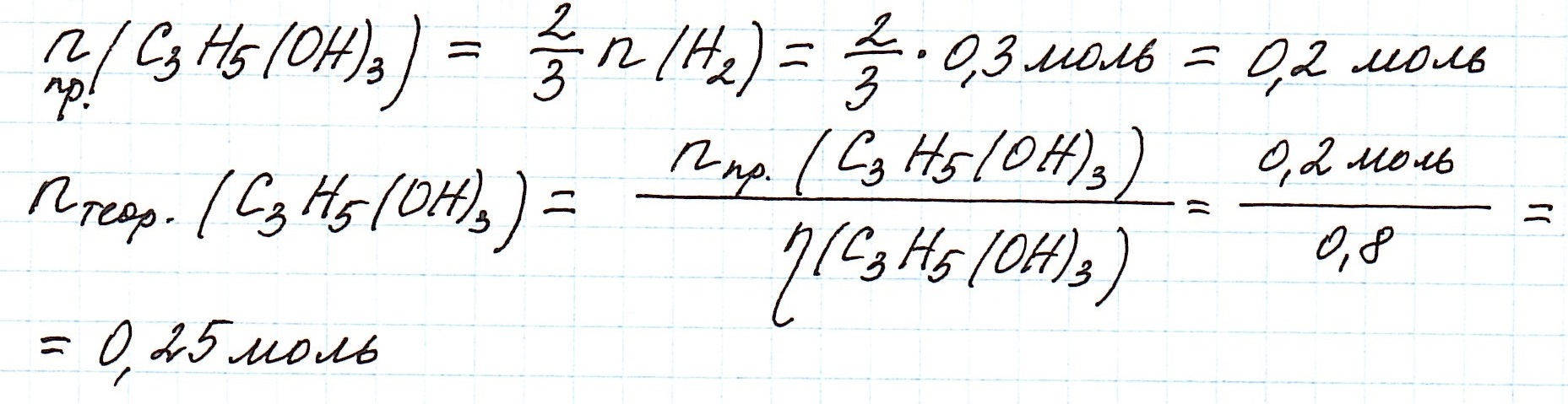
Далее проведем расчет по уравнению реакции (1) для вычисления требуемой массы пропилена:
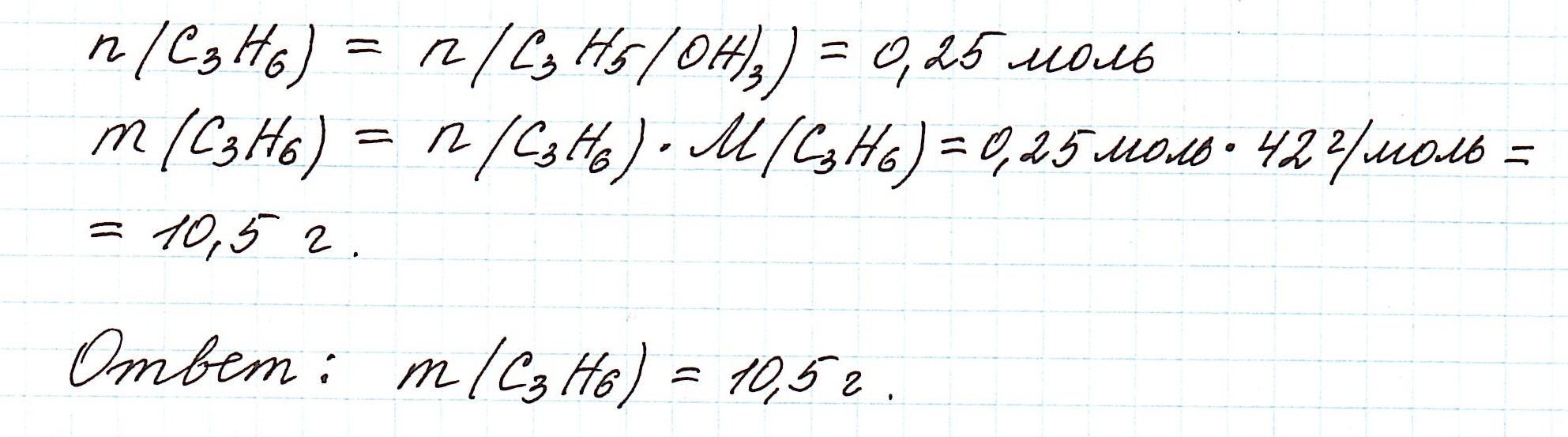
выход продукта реакции
В качестве примеров использованы задачи из сборника:
Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд., испр. и доп. – М.: «Издательство Новая Волна»: Издатель Умеренков, 2002. – 278 с.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
 ХИМИЯ ДЛЯ ЧАЙНИКОВ
ХИМИЯ ДЛЯ ЧАЙНИКОВ 

