
Как вычислить молярную массу вещества? В каких единицах она измеряется?
А еще есть относительная молекулярная масса. Почему она относительная и численно равна молярной массе? Может быть это одно и то же?
Вот сколько вопросов возникает сразу в отношении такого простого на первый взгляд понятия, как молярная масса.
Разберемся по порядку и научимся ее определять.
Содержание:
2.Почему атомная масса дробная?
3.Относительная молекулярная масса
4.Количество вещества и молярная масса
5.Как вычислить молярную массу вещества
Относительная атомная масса
Огромнейший вклад в развитие и обоснование понятия относительная атомная масса внесли в разное время французский ученый Гей-Люссак, итальянский ученый А.Авогадро и шведский ученый Й.Я. Берцелиус.
Не углубляясь в историю вопроса, вспомним, что любой химический элемент представляет собой определенную разновидность атомов. Сегодня мы знаем, что атомы химических элементов имеют свои особые характеристики.
И самая главная из них, определяющая практически все остальные, это заряд ядра. А так как заряд ядра обусловлен присутствием в нем протонов, а заряд одного протона равен +1, то и количество протонов, соответственно, также является важнейшей характеристикой атомов химических элементов.
Основную массу атома составляет ядро, которое кроме протонов содержит еще и нейтроны. Масса последних сопоставима с массой первых. Оболочку атома составляют электроны.
По числу частиц в атоме, а точнее, по их суммарной массе, атомы химических элементов можно условно разделить на тяжелые и легкие. Например, легким элементом является водород, так как его атомы имеют самую маленькую массу. А свинец — это уже тяжелый элемент. Масса его атома в 302 раза тяжелее массы атома водорода.
Но тем не менее, как бы мы не делили все атомы на тяжелые или легкие, абсолютная масса (mA) каждого из них ничтожно мала, как мала и масса составляющих их частиц. Например,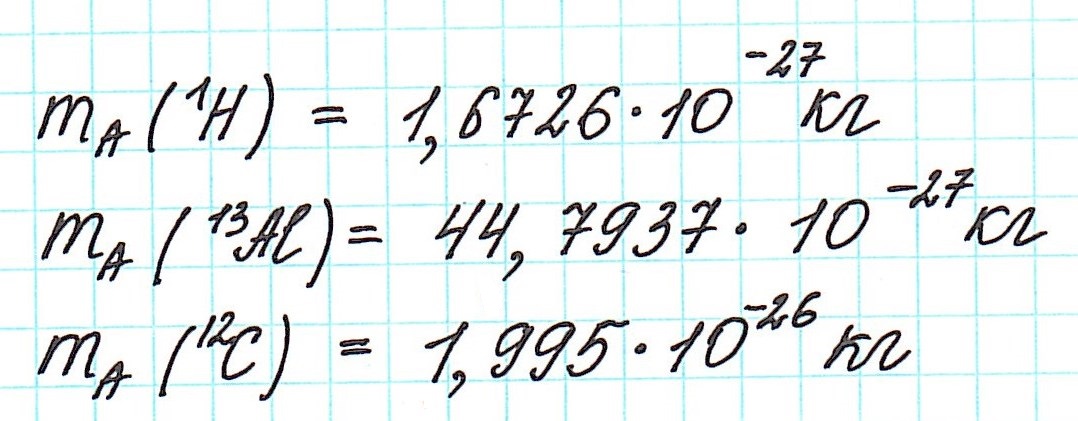 Очевидно, что такие значения крайне не удобны в вычислениях. Поэтому используют не абсолютные, а относительные массы атомов (Ar). То есть массы атомов, посчитанные относительно какой-то определенной одной и той же величины.
Очевидно, что такие значения крайне не удобны в вычислениях. Поэтому используют не абсолютные, а относительные массы атомов (Ar). То есть массы атомов, посчитанные относительно какой-то определенной одной и той же величины.
Величина, с которой сравнивают массу атома
Первоначально еще Дальтон сравнивал массы атомов с массой атома водорода, как самого легкого. Позднее появилась так называемая кислородная единица, равная 1/16 части массы атома кислорода. К ней перешли потому, что большинство атомов химических элементов образуют соединения с кислородом.
Однако, с развитием атомной физики и эта единица стала крайне неудобной. Все потому, что кислород в природе имеет несколько изотопов (а именно 3 устойчивых, всего же их 16). А изотопы, как известно, отличаются своей атомной массой. Из-за большого разнообразия изотопов и их различной устойчивости кислородная единица утратила свою актуальность.
В настоящее время (с 1961 года) общепринятой является углеродная единица, так называемая атомная единица массы (сокращенно а.е.м.). Она равна 1/12 части массы атома углерода (изотопа 12С).
Почему именно углерод? Да потому, что:
— у углерода всего 2 изотопа: 12С и 13С; причем первого 98,9%;
— количество органических веществ (их основу составляет, как известно, именно углерод) в сотни раз больше, чем неорганических;
— при переходе от кислородной единицы к углеродной уже посчитанные относительные атомные массы всех элементов изменились не существенно, что оказалось очень удобным.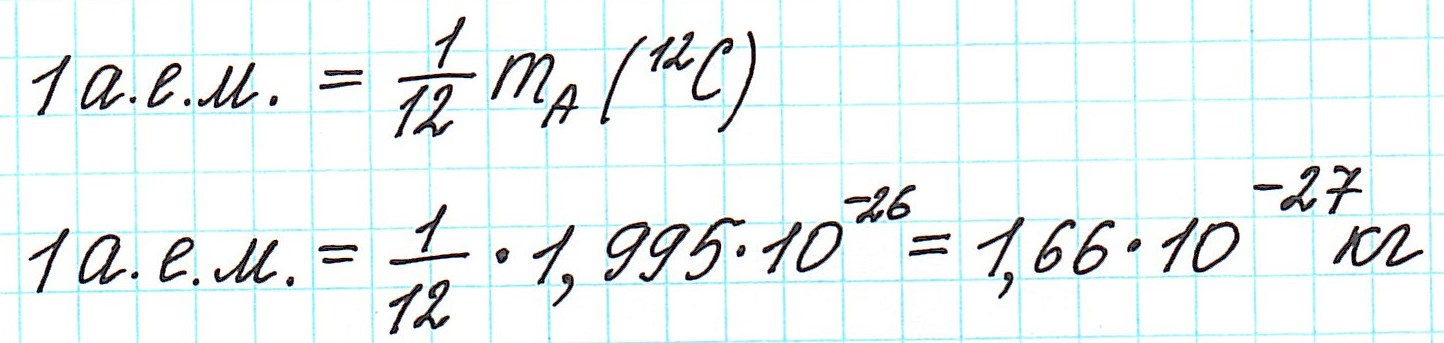 Таким образом, масса атома любого химического элемента связана с массой атома углерода как относительная атомная масса:
Таким образом, масса атома любого химического элемента связана с массой атома углерода как относительная атомная масса: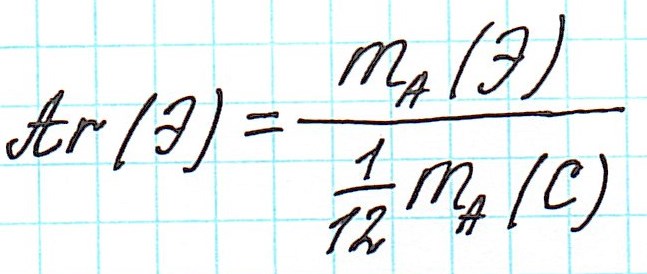 Зная значения абсолютных масс атомов и а.е.м. найдем Аr:
Зная значения абсолютных масс атомов и а.е.м. найдем Аr: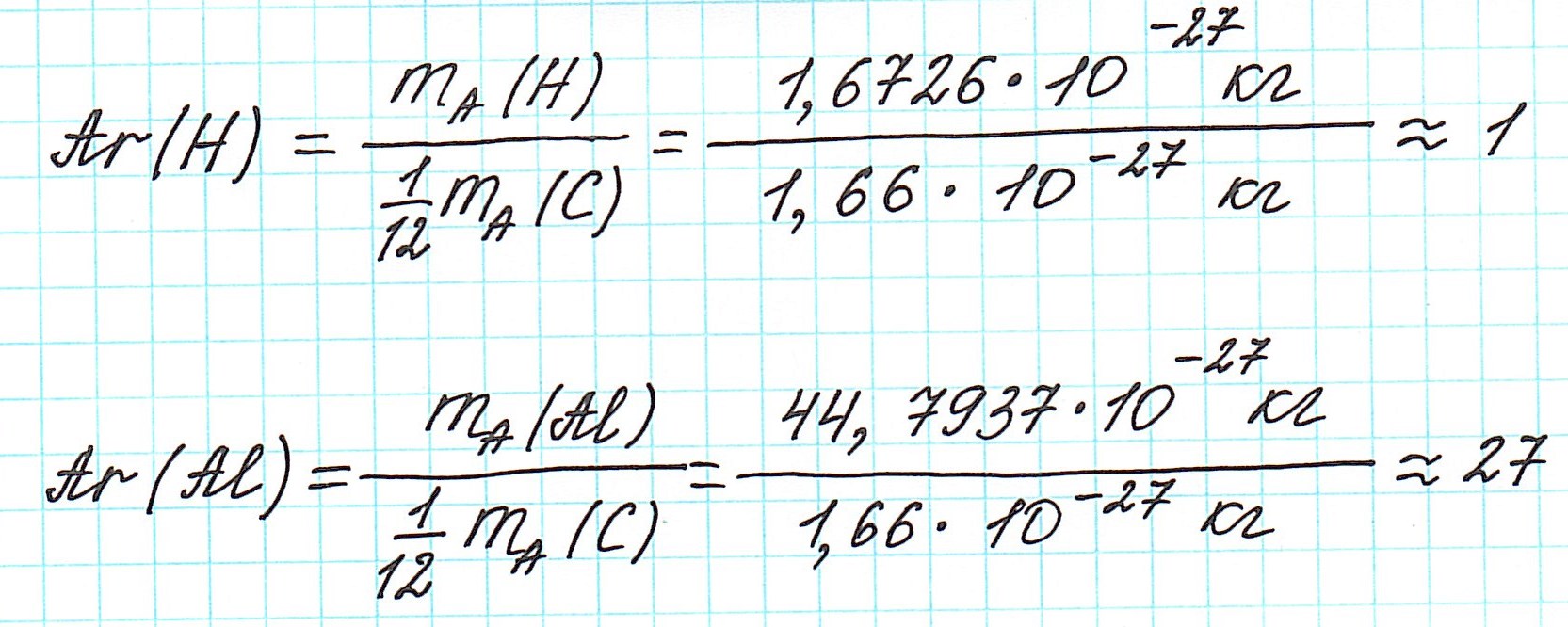 Ar считается безразмерной величиной, либо величиной в а.е.м. Но «а.е.м.» обычно не пишут, оставляя значение Ar без единиц измерения.
Ar считается безразмерной величиной, либо величиной в а.е.м. Но «а.е.м.» обычно не пишут, оставляя значение Ar без единиц измерения.
Почему атомная масса дробная?
Вернемся к строению атома.
Масса атома складывается из массы всех составляющих его частиц.
Массы протона и нейтрона приняты равными 1. А вот массой электрона обычно пренебрегают (по крайней мере в химии), так как даже относительная она безнадежно мала (0,0005485799090659(16) а.е.м.). То есть можно сказать, что масса атома определяется массой его ядра.
В составе ядра целое количество частиц. Например, в атоме одного из изотопов кислорода 8 протонов и 8 нейтронов. Значит, его Ar должна быть равна 16. Так почему же Ar представлена в периодической системе химических элементов в виде десятичной дроби? Для кислорода это Ar(О)=15,9994.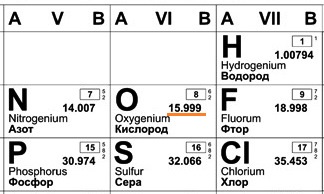 Дело в том, что в периодической системе указаны относительные атомные массы, посчитанные с учетом всех существующих в природе изотопов элемента. А содержание их в природе разное.
Дело в том, что в периодической системе указаны относительные атомные массы, посчитанные с учетом всех существующих в природе изотопов элемента. А содержание их в природе разное.
Например, химический элемент кислород в природе состоит на 99,76% из изотопа 16О, на 0,04% из изотопа 17О и на 0,20% из изотопа 18О. Таким образом, Ar для кислорода является средним значением, учитывающим относительное содержание его изотопов.
Относительная молекулярная масса
А как же найти относительную молекулярную массу?
Здесь не все так просто. Понятие «относительная молекулярная масса» не всегда применяется корректно. Правильнее было бы говорить о «формульной массе».
Дело в том, что молекулы характерны для веществ с ковалентными связями: вода H2O, серная кислота H2SO4, глюкоза C6H12O6 и т.д. И к ним в полной мере можно применить термин «относительная молекулярная масса».
Так как молекулы состоят из атомов, то относительная молекулярная масса (Mr) будет складываться из их относительных атомных масс. Например: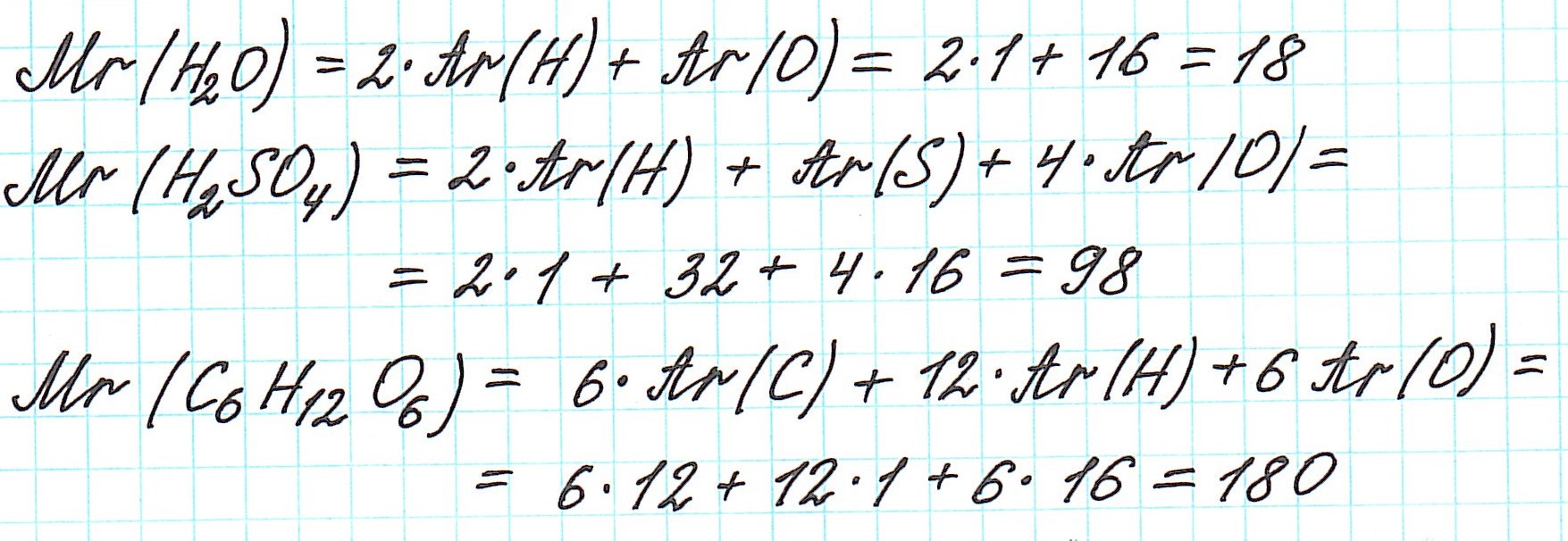 А вот металлы (как простые вещества) и ионные соединения молекул не имеют. Их кристаллические решетки состоят из бесконечного количества атомов и ионов. Поэтому молекулярная формула таких соединений отражает количественные соотношения частиц в кристалле.
А вот металлы (как простые вещества) и ионные соединения молекул не имеют. Их кристаллические решетки состоят из бесконечного количества атомов и ионов. Поэтому молекулярная формула таких соединений отражает количественные соотношения частиц в кристалле.
Например, формула NaCl показывает, что в кристалле хлорида натрия на один ион натрия Na+ приходится один ион хлора Cl—. На самом деле формула хлорида натрия должна выглядеть так: Na∞Cl∞. Поэтому запомним, что к ионным соединениям термины «молекула» и «молекулярная масса» не применимы.
В связи с этим для подобных веществ вычисляется формульная масса. А вычисляется она все по тому же принципу, что и молекулярная масса. Обозначается так же — Mr. Например, для хлорида натрия: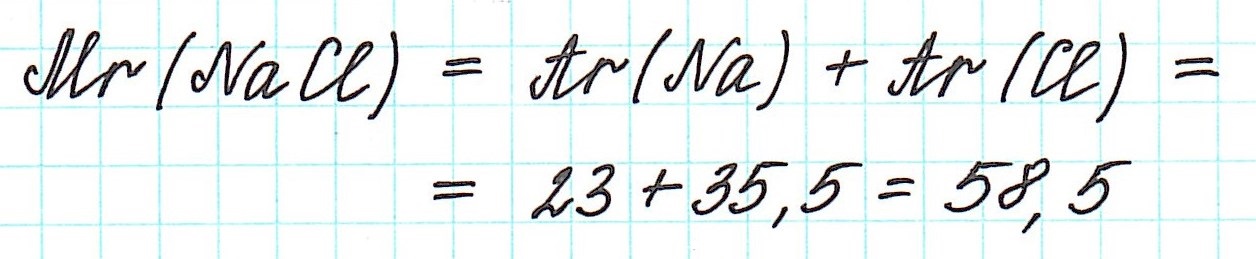
Точно так же, как относительную атомную массу (Ar), относительную молекулярную массу (Mr) будем сопоставлять с 1/12 частью атома изотопа углерода 12С.
В последующем говорим о Mr.
Количество вещества и молярная масса
В практических расчетах все-таки требуется вычислять массы, взятые в граммах, килограммах ато и в тоннах (если речь идет о каком-то производстве, например).
Как же поступают тогда?
Введена новая и тоже относительная величина – моль.
Точно было посчитано, что определенное количество атомов изотопа углерода 12С, а именно 6,02·1023, имеют массу ровно 12 г. Обратите внимание, что относительная молекулярная масса для этого же изотопа равна 12, но не грамм!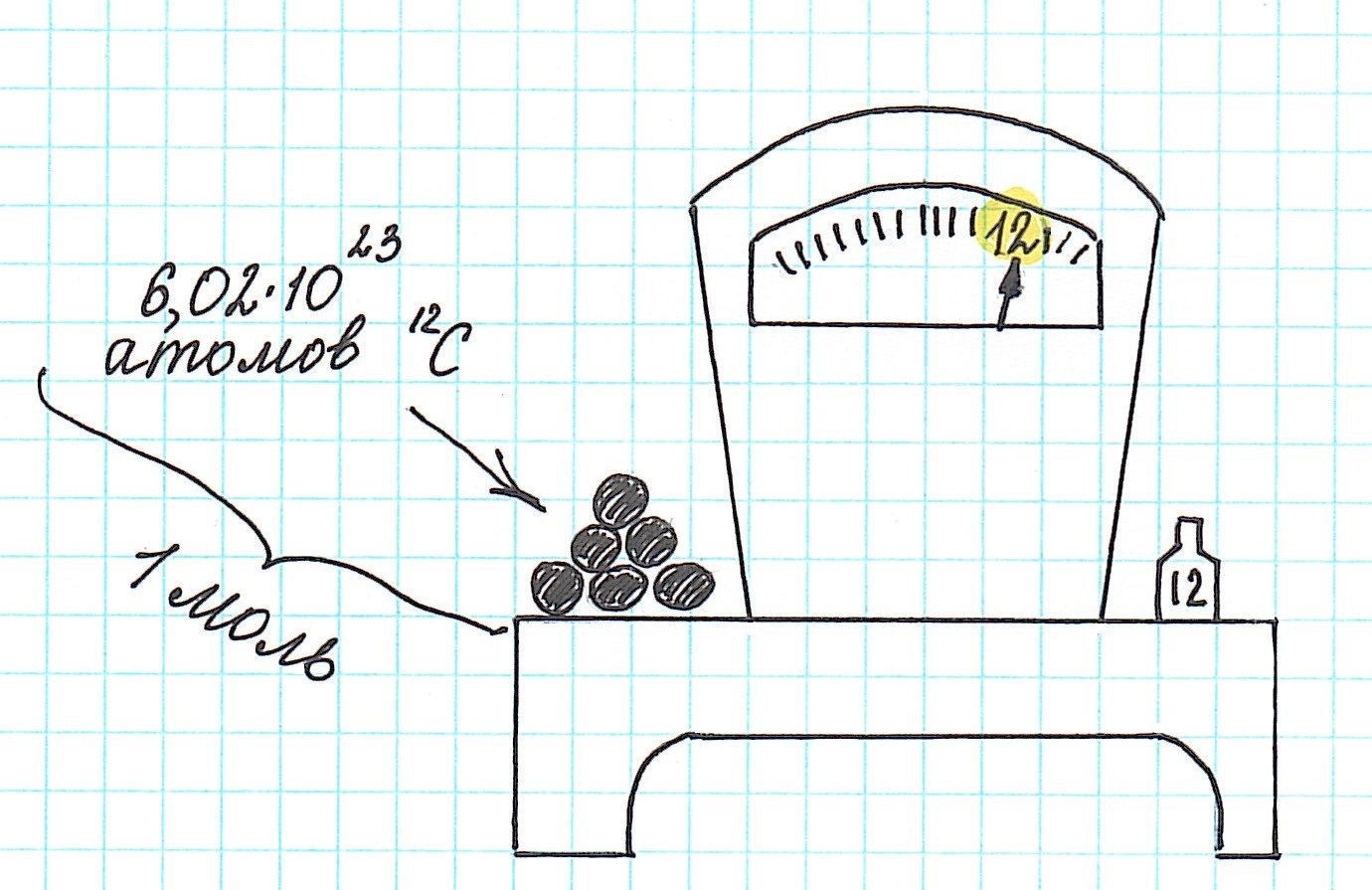
Количество вещества, которое содержит столько же частиц (атомов, ионов, молекул – в зависимости от строения), что и 12 г изотопа углерода 12С, назвали молем.
Один моль вещества (любого!) всегда содержит 6,02·1023 его частиц (постоянная Авогадро).
Ну, а так как атомы элементов отличаются по своей массе, то и 1 моль вещества тоже будет отличаться по массе. ! Обратите внимание, что в русском языке «моль» мужского рода! (это не как моль бабочка).
! Обратите внимание, что в русском языке «моль» мужского рода! (это не как моль бабочка).
Массу одного моля вещества называют молярной массой (М) и вычисляют в г/моль.

Таким образом, молярная масса и количество вещества связаны соотношением: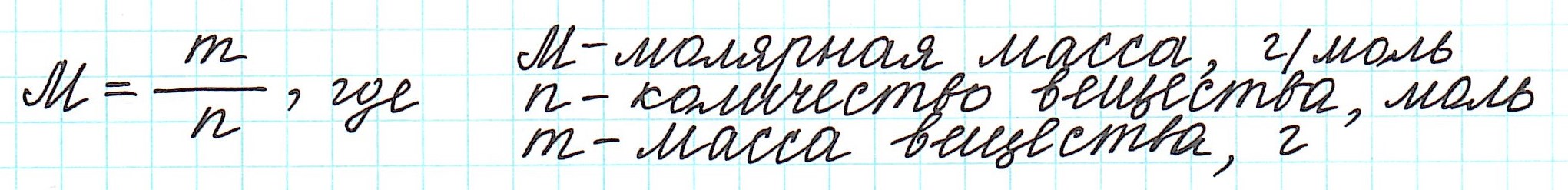
Можно также определить и такие отношения, связанные с количеством вещества: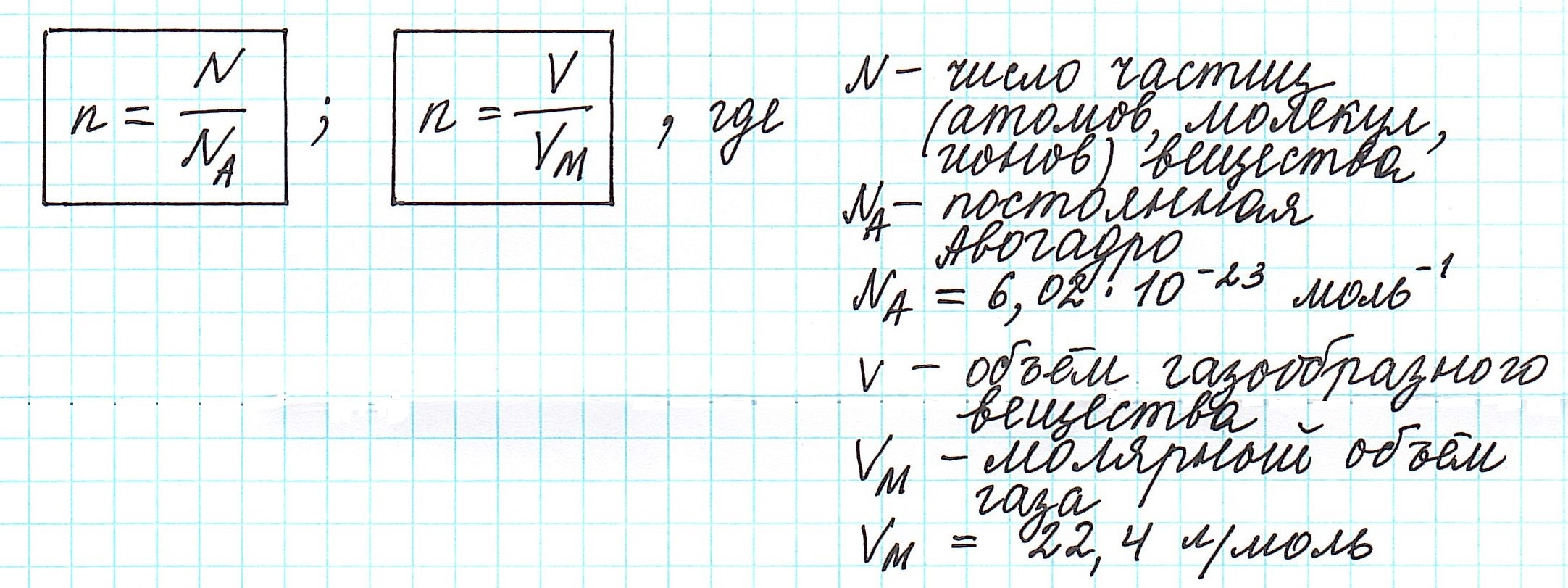
Почему же относительная молекулярная и молярная массы равны?
Итак, относительная молекулярная и молярная массы, как следует из их определений – это не одно и то же.
Докажем, каким образом обе массы численно могут быть равны:

Как вычислить молярную массу вещества
Мы уже знаем, что относительная молекулярная масса складывается из относительных атомных масс.
При нахождении относительной молекулярной массы (Mr), а значит и молярной (М), выполняем следующие действия:
1) правильно записываем формулу вещества;
2) анализируем качественный состав (атомы каких элементов составляют вещество) и количественный состав (в каких количествах находятся эти атомы – смотрим по индексам, которые стоят справа внизу от знака химического элемента);
3) в периодической системе химических элементов находим элементы, атомы которых составляют вещество, и округляем относительную атомную массу, стоящую рядом со знаком элемента, до целого числа (! у хлора – до 35,5);
4) складываем относительные атомные массы всех элементов с учетом количества атомов.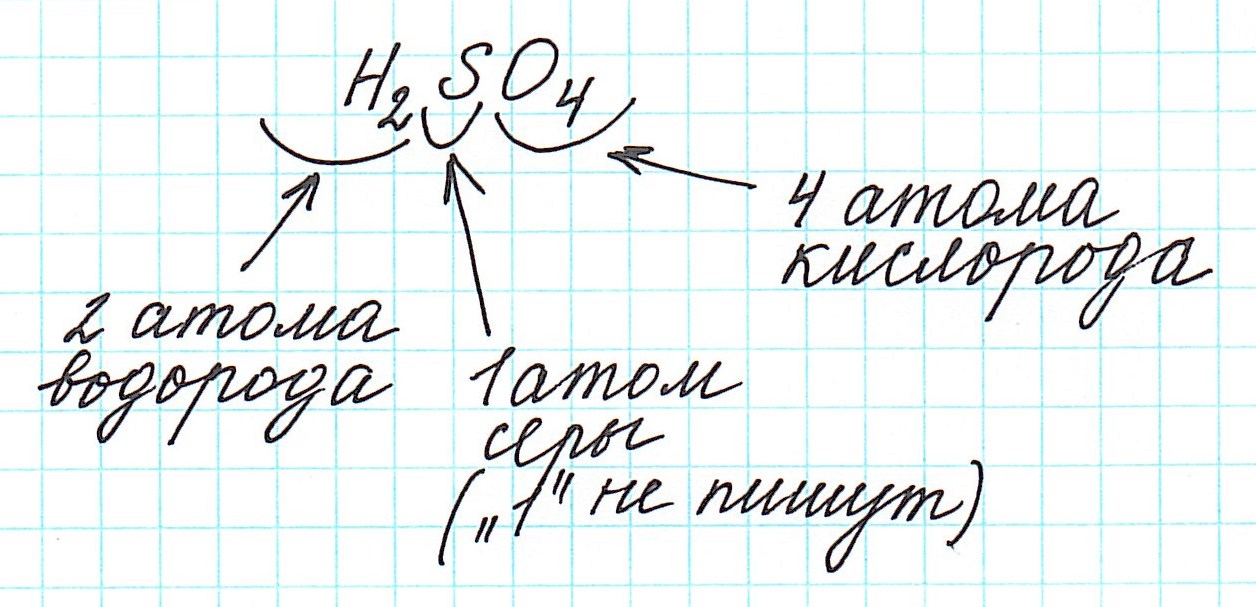

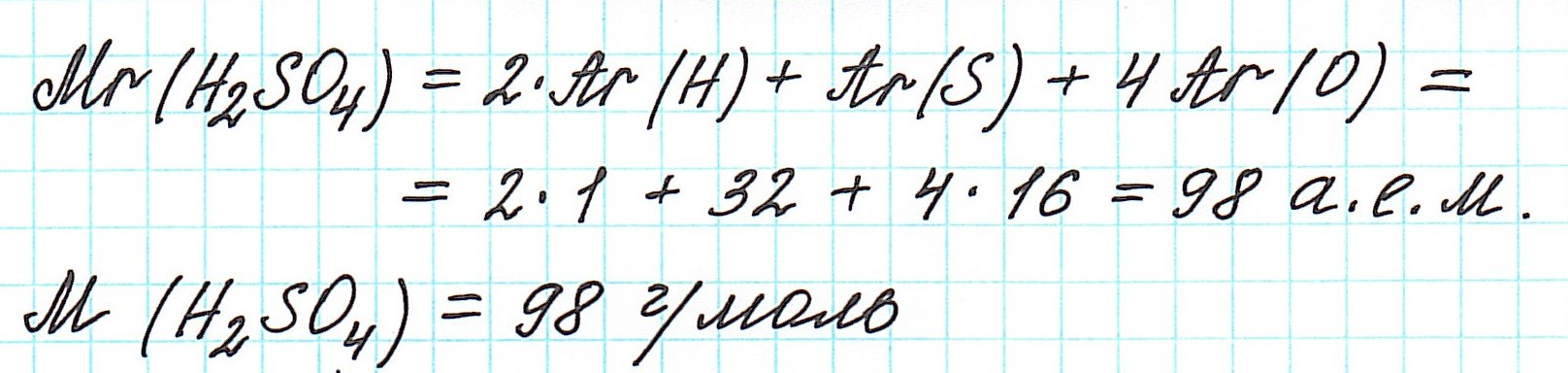
Рассмотрим еще примеры:
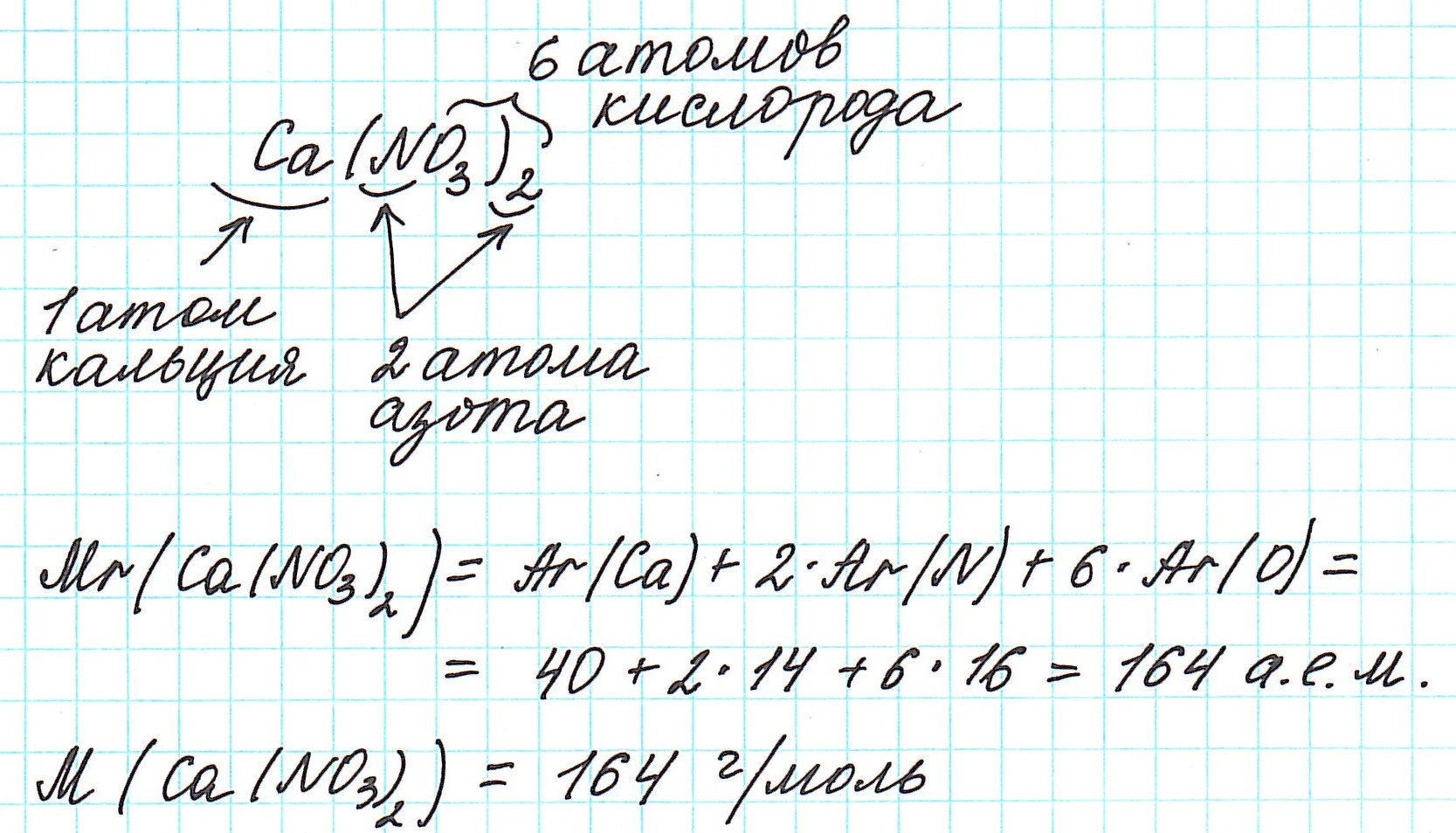
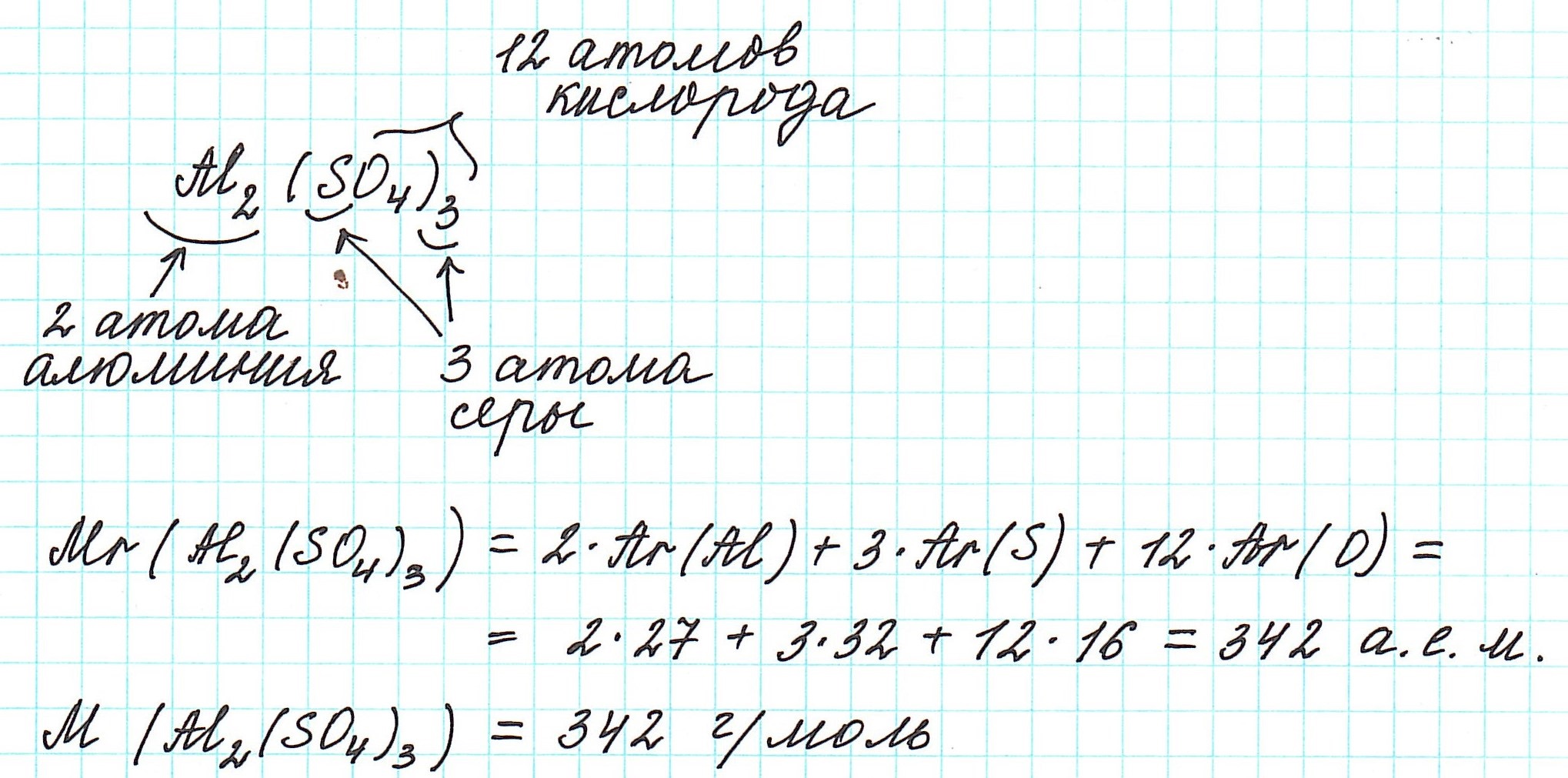
Как вычислить молярную массу вещества, находящегося в газообразном состоянии
Определить молекулярную (а значит и молярную) массу газообразного вещества можно, используя закон Авогадро. Он гласит, что в равных объемах газов, взятых при одинаковой температуре, а также одинаковом давлении, содержится равное число молекул.
Это означает, что в данных условиях отношение масс газов друг к другу является отношением их молярных масс: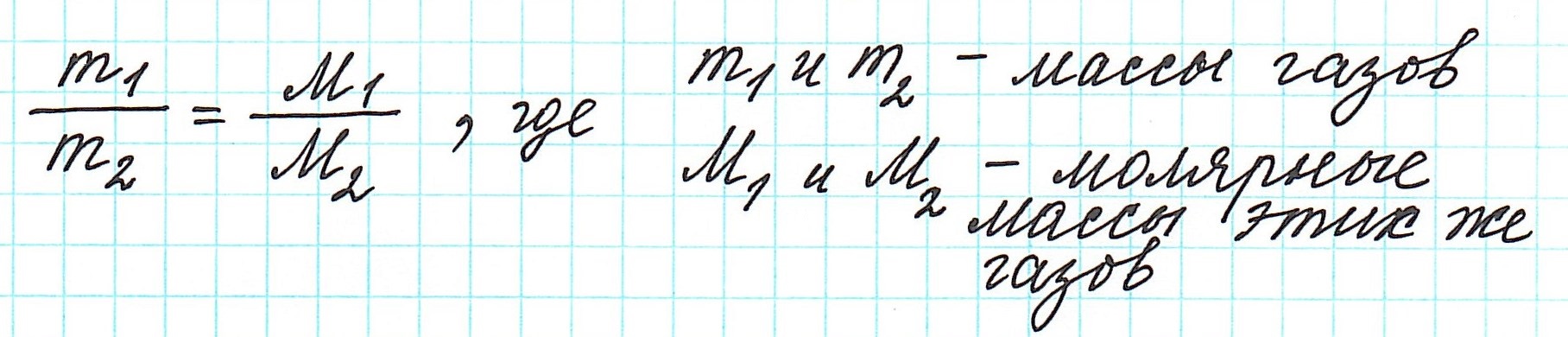 Отношение масс газообразных веществ называют относительной плотностью одного газа по другому и обозначают как D:
Отношение масс газообразных веществ называют относительной плотностью одного газа по другому и обозначают как D: Таким образом, зная молярную массу одного газа и его плотность по другому газу, можно вычислить молярную (а значит, и молекулярную) массу второго газа:
Таким образом, зная молярную массу одного газа и его плотность по другому газу, можно вычислить молярную (а значит, и молекулярную) массу второго газа: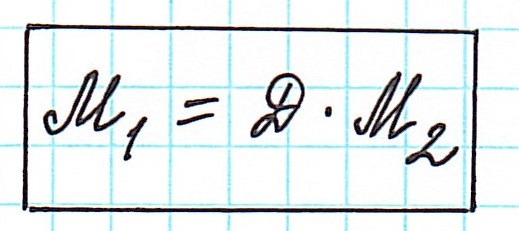 Например:
Например: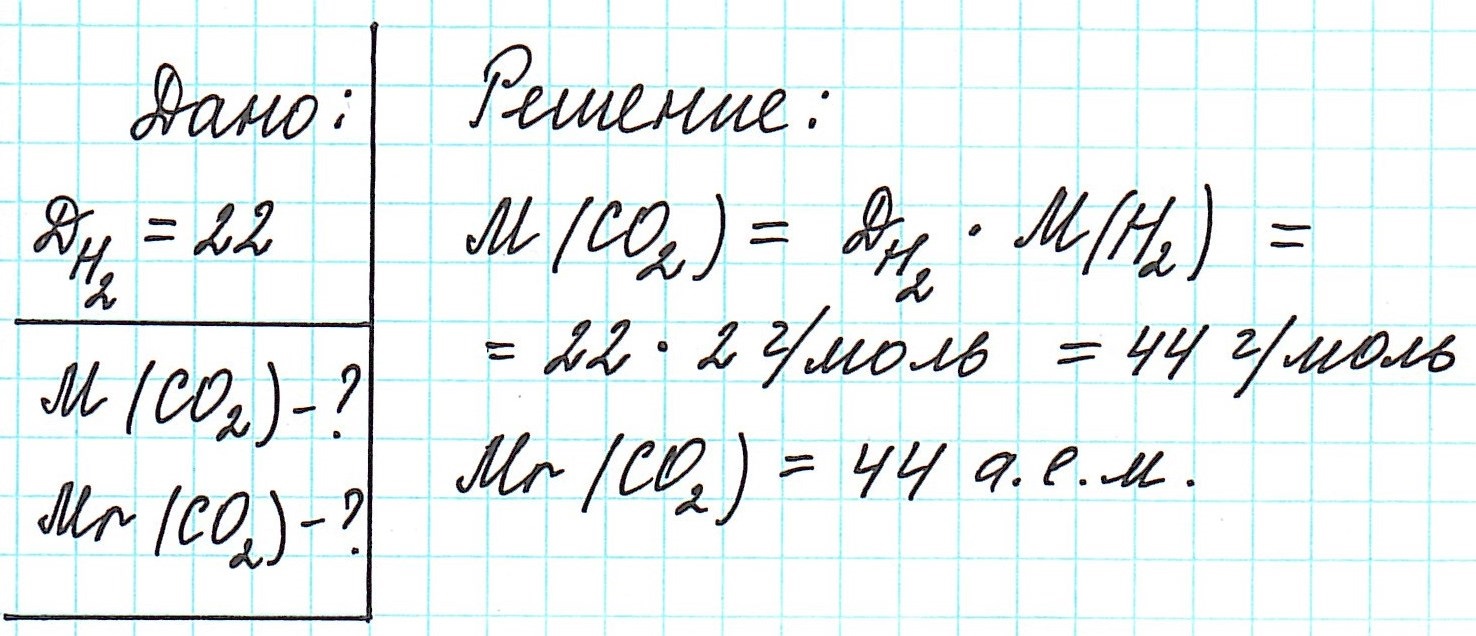
Запомните, что средняя молярная масса воздуха равна 29 г/моль.
Вычислить молярную массу вещества (а, значит, и относительную молекулярную), находящегося в газообразном состоянии, можно, используя молярный объем газа (VM):
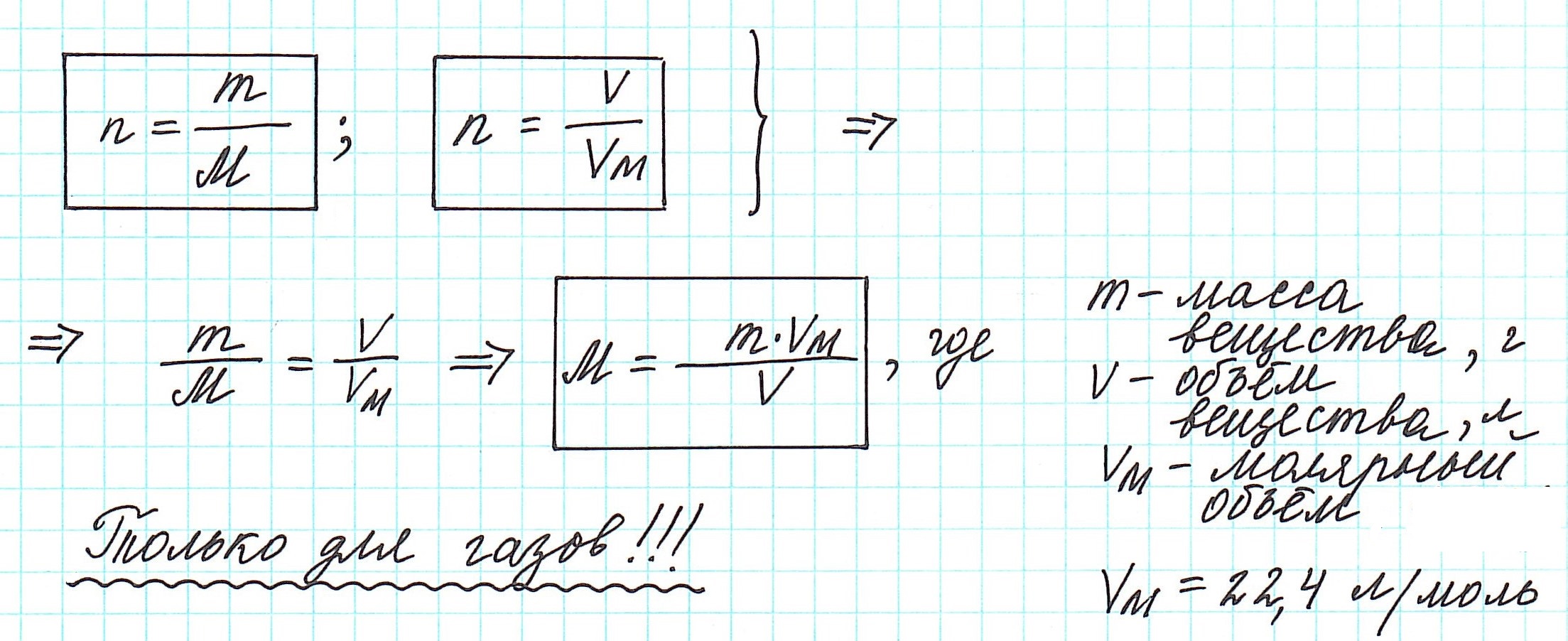
Итак, подведем итог:
- Относительная молекулярная масса (Mr) показывает отношение массы молекулы к 1/12 части массы атома изотопа углерода 12С.
- Молярная масса (М) – масса одного моля вещества, равная отношению массы вещества к его количеству и выраженная в г/моль.
- Относительная молекулярная и молярная массы численно равны.
- Вычислить молярную массу вещества (и относительную молекулярную также) можно, используя значения относительных атомных масс, записанных в периодической системе.
Без вычисления молярной массы не обходится решение практически ни одной задачи. Если вы поняли, что такое молярная и относительная молекулярная массы и как их вычислять, но еще не умеете решать задачи с их применением, то самое время научиться.
Разбор простых типовых задач по химии в книге, которую вы можете совершенно БЕСПЛАТНО скачать здесь.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
 ХИМИЯ ДЛЯ ЧАЙНИКОВ
ХИМИЯ ДЛЯ ЧАЙНИКОВ 

