
Титр раствора. Формула для его расчета достаточно проста и чем-то напоминает формулу для расчета плотности раствора, так как выражается в тех же единицах.
Титр раствора: формула для расчета
Титр – один из способов выражения количественного состава раствора. Является основной концентрацией в титриметрическом анализе.
Титр (Т) – это масса вещества (в граммах), которая содержится в 1 мл (1 см3) раствора.
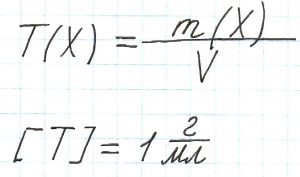
Например, титр раствора азотной кислоты равен 0,005672 г/мл. Это означает, что в каждом одном миллилитре раствора содержится 0,005672 г азотной кислоты.
Переход от титра раствора к другим видам концентраций
В титриметрическом анализе применяются и другие концентрации: молярная (См) и нормальная (Сн). Между ними и титром существует взаимосвязь: можно от одной концентрации перейти к другой. Например, взаимосвязь титра и молярной концентрации.
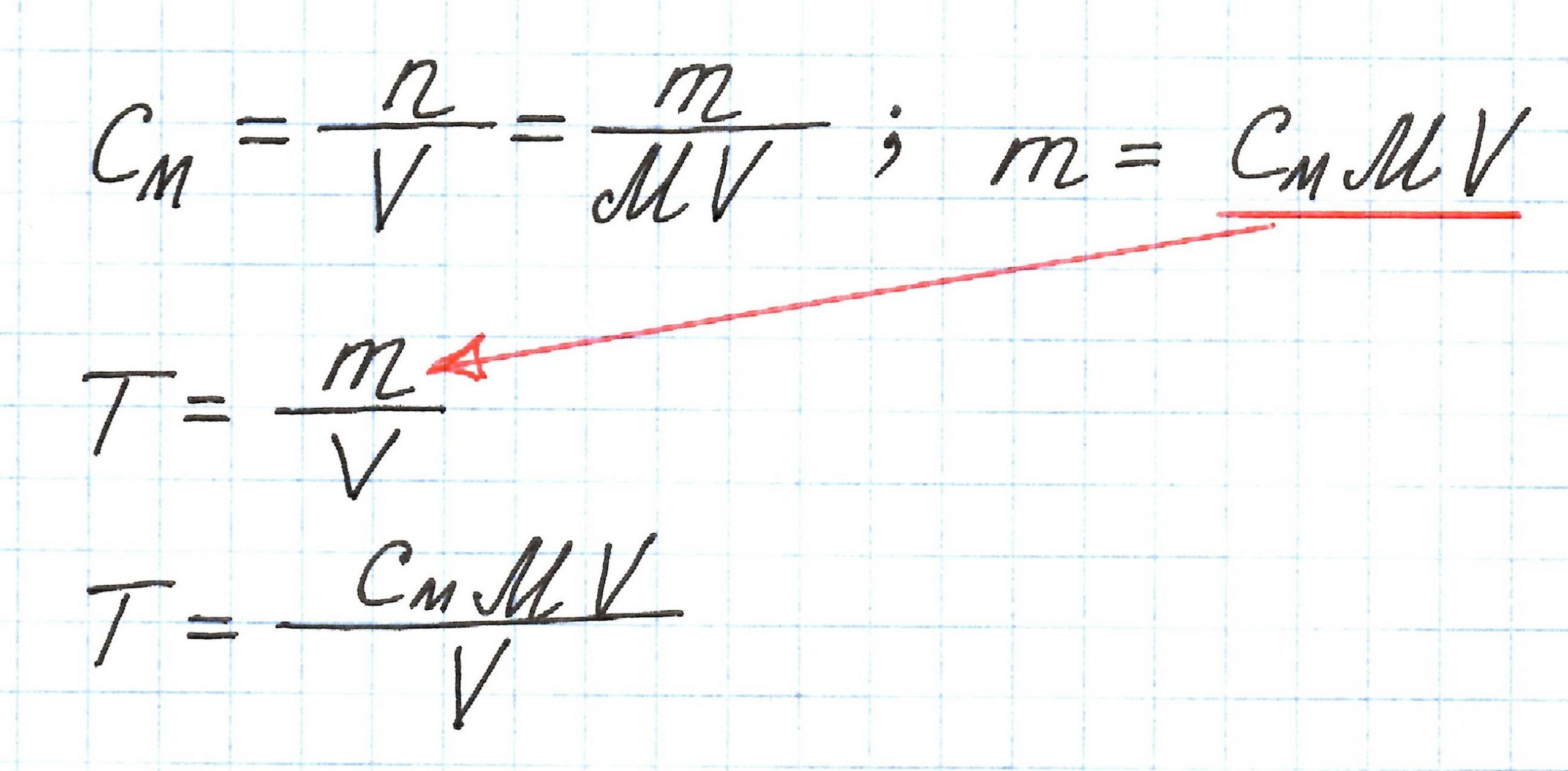
Для См объем измеряется в литрах (л) , для Т – в миллилитрах (мл), то есть в 1000 раз меньше. Учтем это и получим:
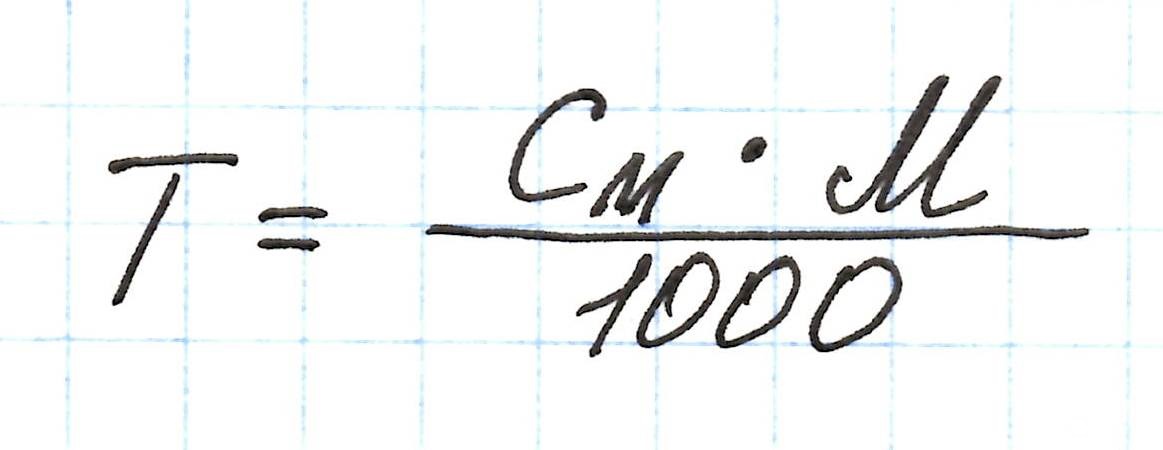
Аналогичные преобразования можно провести и с нормальной концентрацией (Сн). В результате получим:
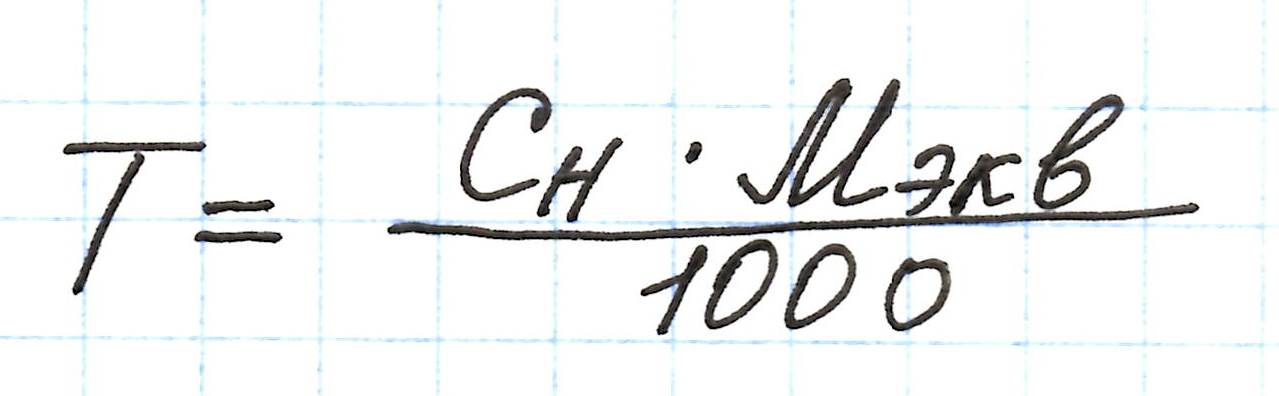
Титр связан и с массовой долей растворенного вещества:
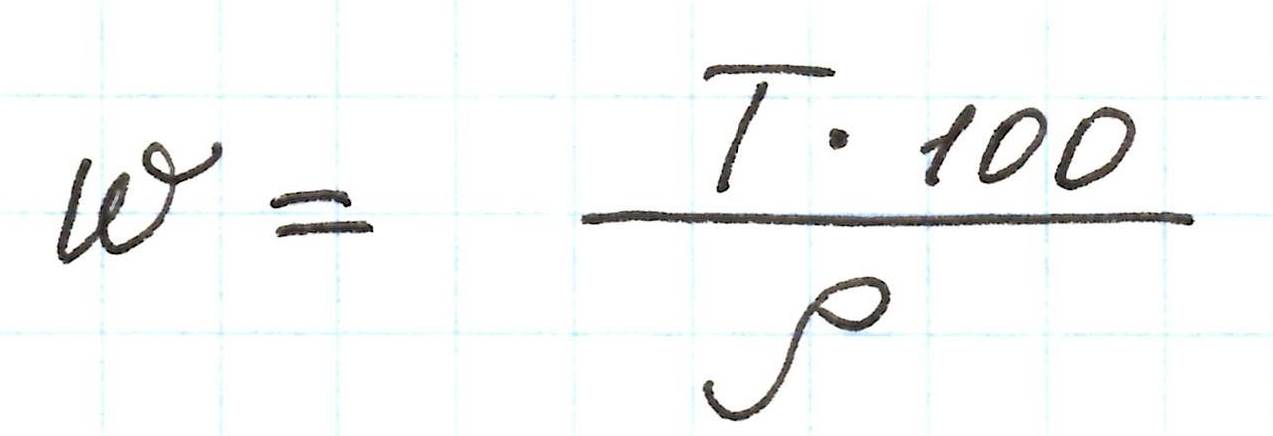
Титр раствора: формула и примеры расчетов
Приведем конкретные примеры вычисления титра раствора и других концентраций, связанных с ним.
Пример 1. Какая масса азотной кислоты содержится в 500 мл раствора, если его титр равен 0,00630 г/мл?

Пример 2. В 1 кг воды растворили 250 г NaOH. Плотность полученного раствора равна 1,219 г/мл. Какова массовая доля NaOH, титр, молярная и нормальная концентрации раствора щелочи.

Пример 3. Титр раствора HCl равен 0,003592 г/мл. Вычислите его нормальную концентрацию.
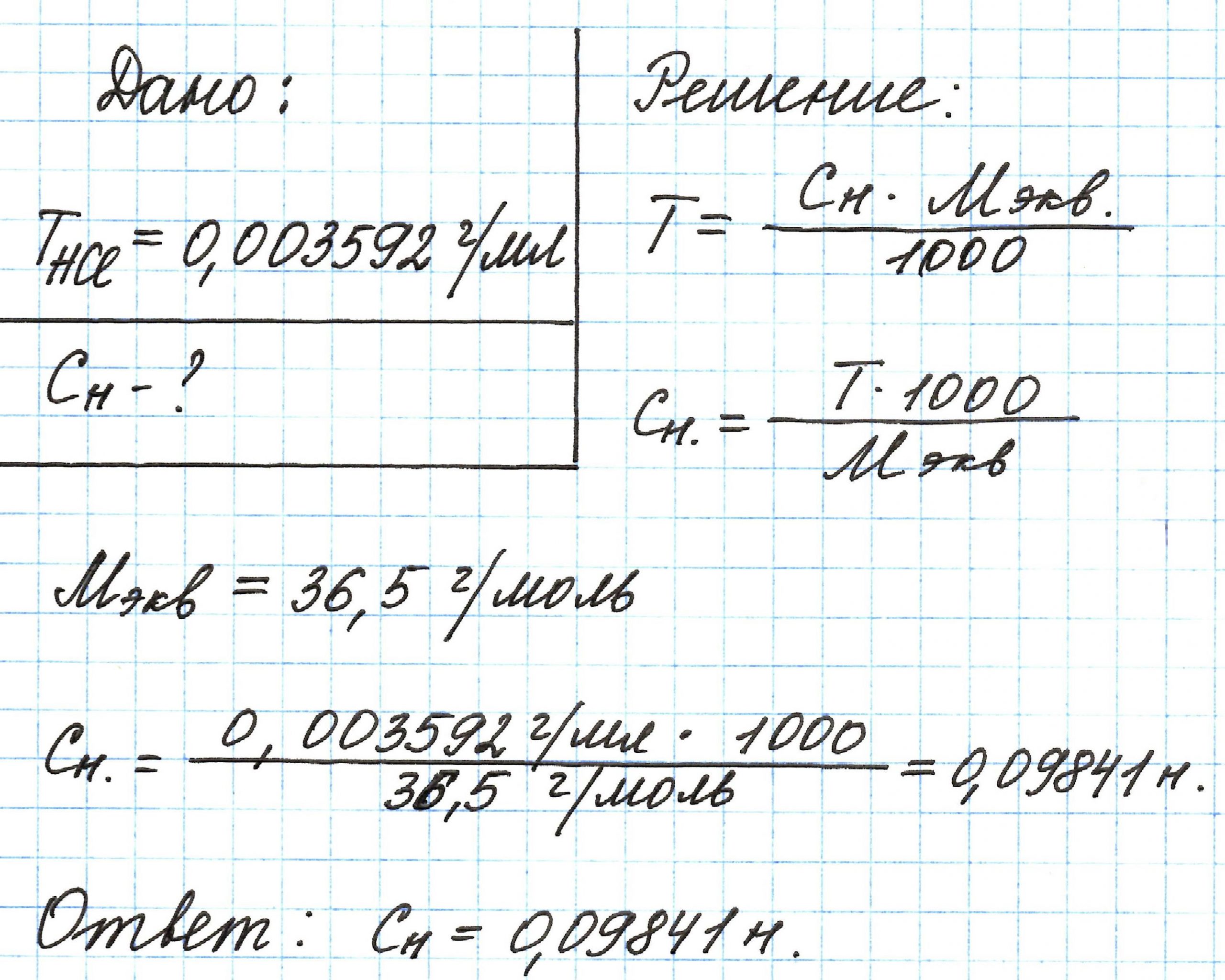
Пример 4. Нормальная концентрация раствора H2SO4 составляет 0,1205 н. Определите его титр.

Пример 5. Какова нормальная концентрация раствора H2C2O4·2H2O, полученного растворением 1,7334 г ее в мерной колбе вместимостью 250 мл?

Пример 6. Питьевую соду массой 4,2 г растворили в дистиллированной воде. Объем раствора составил 200 мл. Каковы титр и молярная концентрация полученного раствора?
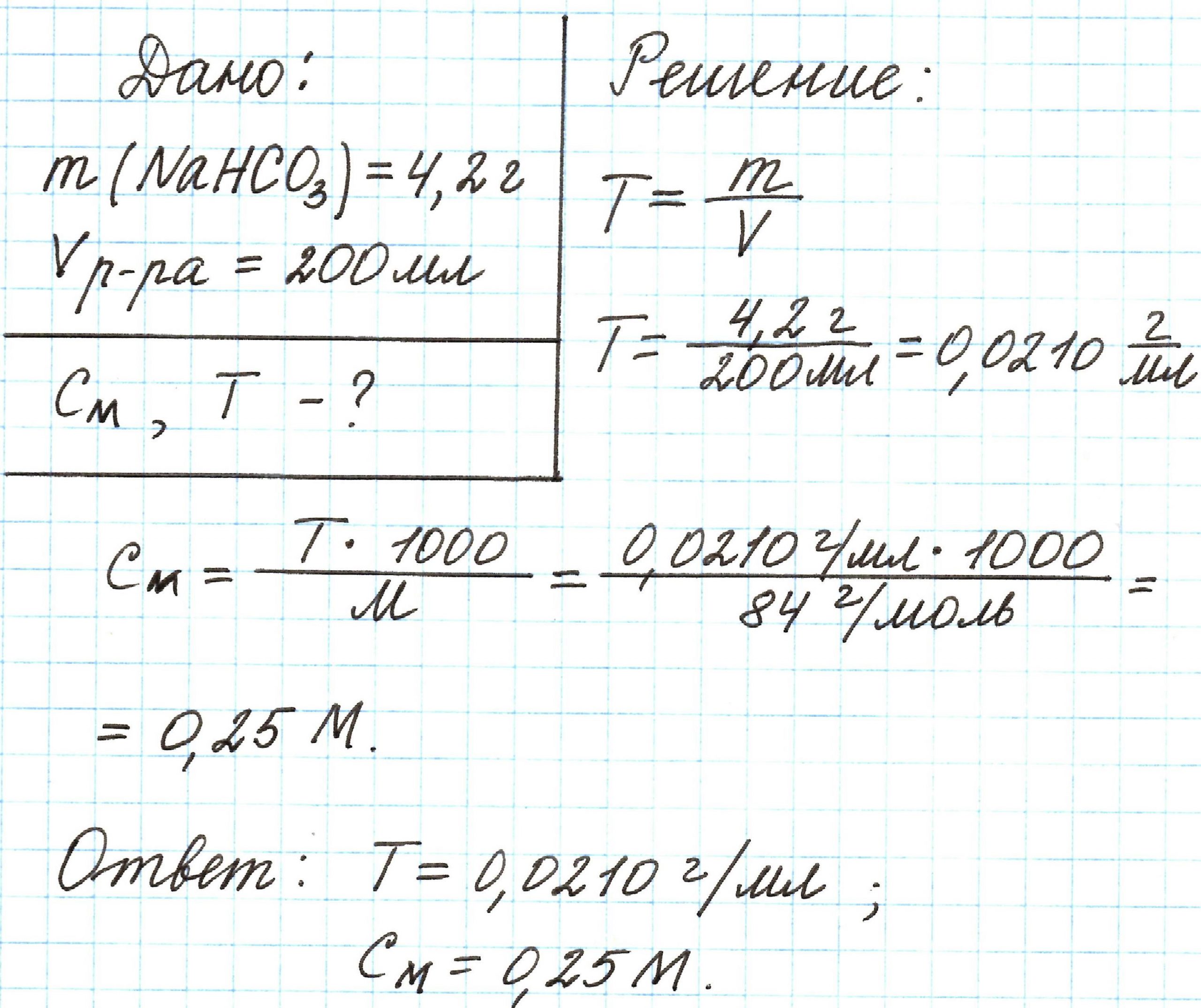
Пример 7. В 100 г раствора (ρ = 1г/мл) хлорида цинка ZnCl2 содержится 5 г соли. Определите титр, массовую долю, молярную и нормальную концентрации раствора.

Таким образом, зная титр раствора, формулу для вычисления его значения, можно перейти к другим видам концентрации раствора, и наоборот.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
![]() Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
 ХИМИЯ ДЛЯ ЧАЙНИКОВ
ХИМИЯ ДЛЯ ЧАЙНИКОВ 

