Э.Д.С. гальванического элемента определяется по формуле, применение которой рассмотрим в данной статье.
Содержание:
1.Что такое Э.Д.С. и от чего она зависит
2. Стандартные электродные потенциалы
2.1.Как устроен и как работает гальванический элемент с водородным электродом
2.2. Э.Д.С. гальванического элемента с водородным электродом
2.4. Ряд напряжений металлов. Что это такое и каково его значение
3.Примеры вычислений Э.Д.С. гальванического элемента и электродных потенциалов
Гальванический элемент является прибором, который позволяет при посредстве химической реакции получить электрическую энергию. А происходит это потому, что один металл готов отдать свои электроны другому, тот же, в свою очередь, их принять.
Но что обеспечивает такую готовность, какая сила заставляет эти электроны перемещаться?
Для сравнения способности одного металла отдавать свои электроны другому измеряют и рассчитывают электродвижущую силу (обозначим ее как Э.Д.С.)
Что такое Э.Д.С. и от чего она зависит
Сила, позволяющая перемещаться электронам по цепи в гальваническом элементе, называется электродвижущей силой (E), которая в данном случае означает то же, что и напряжение, и потенциал. Поэтому Э.Д.С. измеряется в вольтах.
Вспомним, что 1 вольт (В) представляет собой электродвижущую силу, которая позволяет заряду в 1 кулон (Кл) приобрести энергию в 1 джоуль (Дж).
ЭДС гальванического элемента определяется многими факторами:
— проводимым в элементе химическим процессом;
— концентрацией участников процесса (как реагентов, так и продуктов);
— температурой.
Если гальванический элемент работает в стандартных условиях, то его Э.Д.С. называется стандартной и обозначается Е°.
Стандартные электродные потенциалы
Еще со времен Галилея известно, что все в мире относительно. С тех пор любые события, процессы и явления мы можем рассматривать относительно других событий, процессов или явлений.
Чтобы понять, какова же Э.Д.С. конкретного металла, нужно сравнить ее с такой Э.Д.С., величина которой нам наверняка известна. Для этого был составлен гальванический элемент с газообразным водородом в качестве электрода.
Как устроен и как работает гальванический элемент с водородным электродом
Значение потенциала водородного электрода, с которым будут сравниваться величины измеряемых потенциалов электродов гальванического элемента, условно принимается на ноль.
Конечно же сам водород подключить к цепи мы не можем, так как это газообразное вещество.
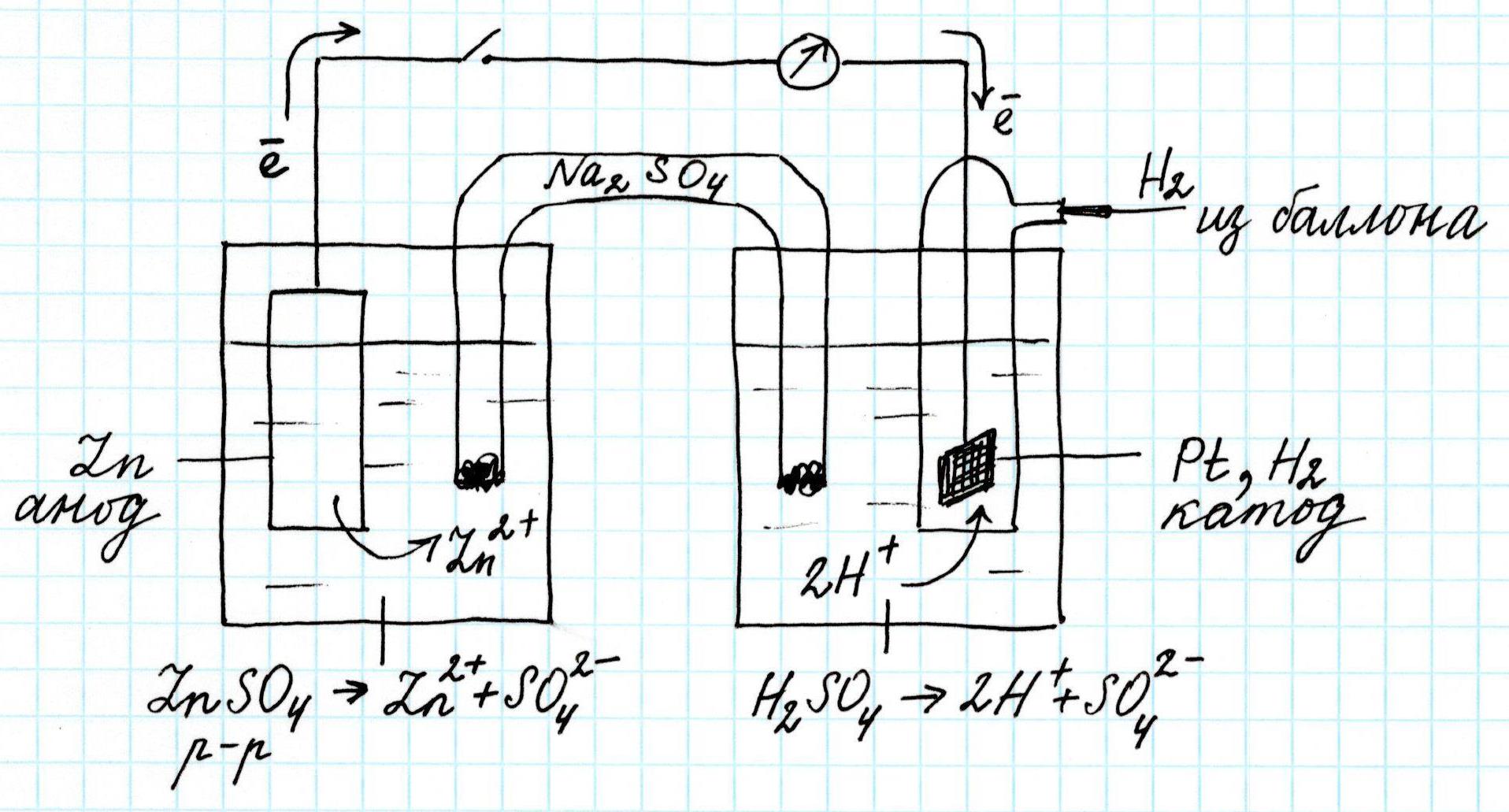
Итак, в цепь включена тонкая платиновая Pt пластинка, имеющая дополнительное покрытие из платины, осажденной на ее поверхности электролитическим путем. Здесь адсорбируется газообразный водород, который дополнительно удерживается стеклянной колбой. Последняя же заполнена электролитом: 2н. раствором серной кислоты H2SO4. Кроме того, сюда из баллона подается водород H2.
Вторая часть гальванического элемента, как обычно, представлена цинковой пластинкой (анод), погруженной в раствор соли этого же металла, например, сульфата цинка ZnSO4 . Электроны анода после замыкания цепи переходят в катодное пространство и обеспечивают там восстановление ионов водорода H+:
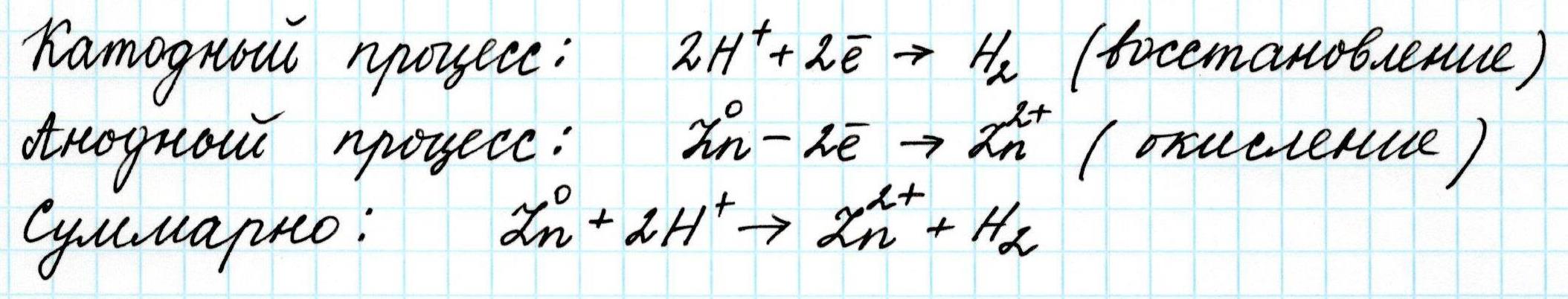
Схематично рассмотренный гальванический элемент записывают так:
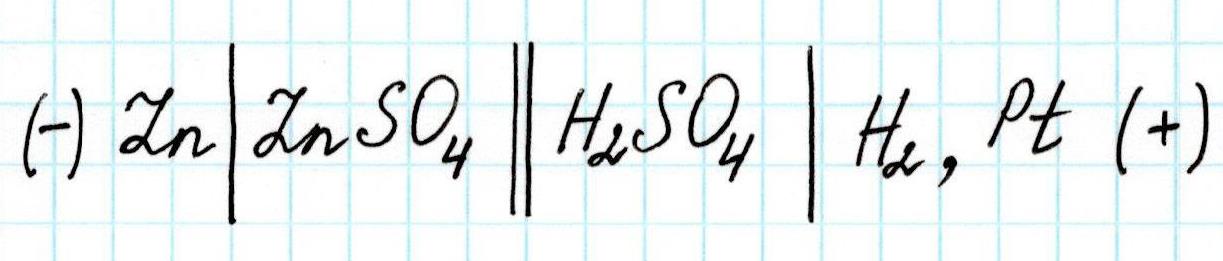
После замыкания цепи стрелка прибора покажет величину потенциала 0,76 В.
ЭДС гальванического элемента с водородным электродом
Итак. Стрелка вольтметра остановилась на значении 0,76 В. Это и есть величина Э.Д.С. гальванического элемента, устройство которого мы рассмотрели.
Поскольку в гальваническом элементе всегда одновременно протекают два противоположных процесса: окисление и восстановление, то Э.Д.С. элемента будет представлена суммой двух потенциалов: окислительного и восстановительного соответственно

Тогда посчитаем:
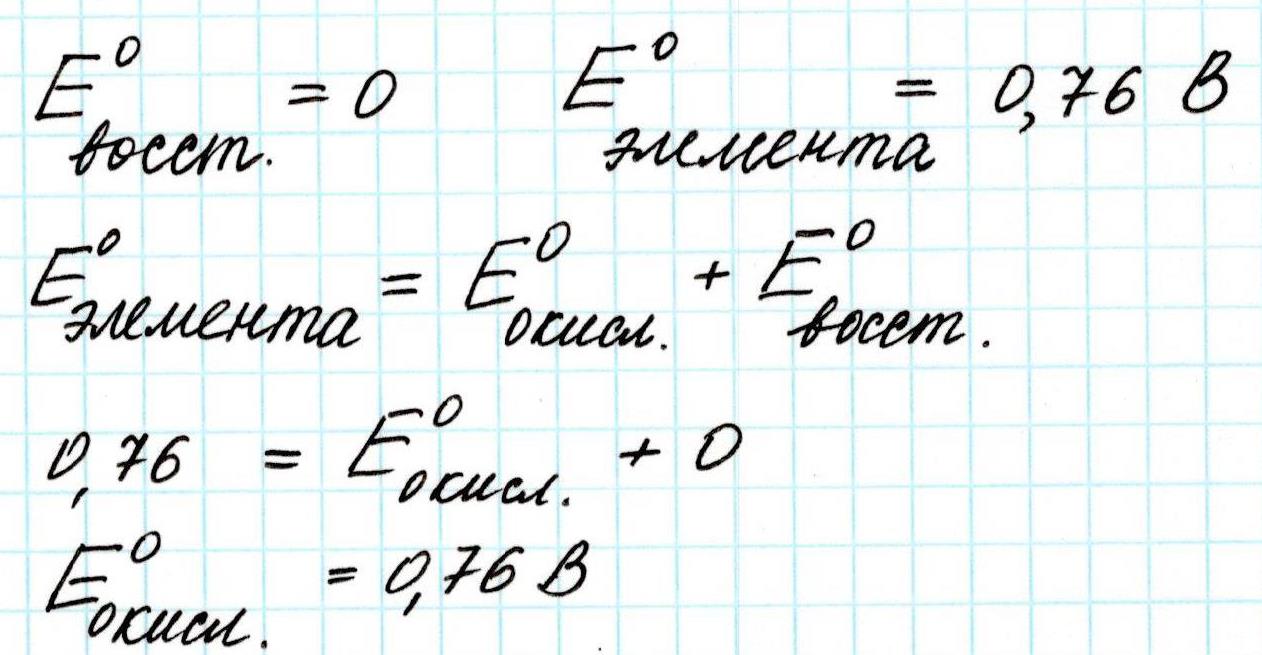
Поскольку в ходе процесса окисляется цинк, посчитанное (и измеренное) значение Э.Д.С. будет относиться не столько ко всему элементу, сколько к цинковому аноду.
Именно таким же образом, имея в распоряжении стандартный водородный электрод, были получены значения других стандартных электродных потенциалов.
Э.Д.С. гальванического элемента определяется по формуле, учитывающей электродные потенциалы участников процесса
Возможны случаи, когда электрод в одном гальваническом элементе является анодом, а в другом (в паре с другим металлом) катодом. Иными словами, в зависимости от ситуации он может как окисляться, так и восстанавливаться. Какой же электродный потенциал будет иметь металл?
В таких ситуациях работает правило:
потенциалы окислительного и восстановительного процессов имеют одинаковое численное значение и противоположны по знаку
Например, для цинка:

Важно отметить, что в справочных таблицах стандартных электродных потенциалов принято отображать только восстановительные процессы. Поэтому, если электрод, значение Э.Д.С. которого вам надо взять из такой таблицы, является участником окислительного процесса, вы находите в ней значение Э.Д.С. для него, как для участника восстановительного процесса, и меняете знак на противоположный.
Итак, в самом общем случае Э.Д.С. гальванического элемента определяется по формуле:
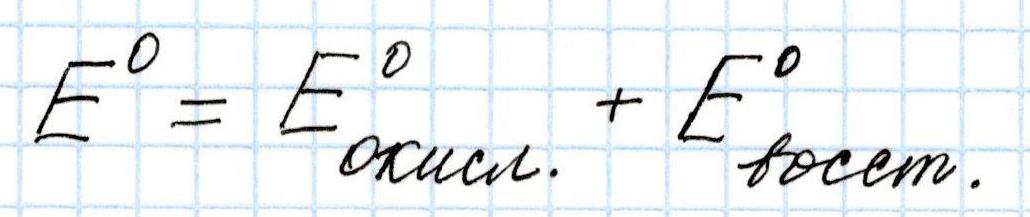
Необходимо учесть, что
Э.Д.С. гальванического элемента всегда положительна
Определим Э.Д.С. гальванического элемента, состоящего из медного и цинкового электродов, погруженных в растворы их солей:
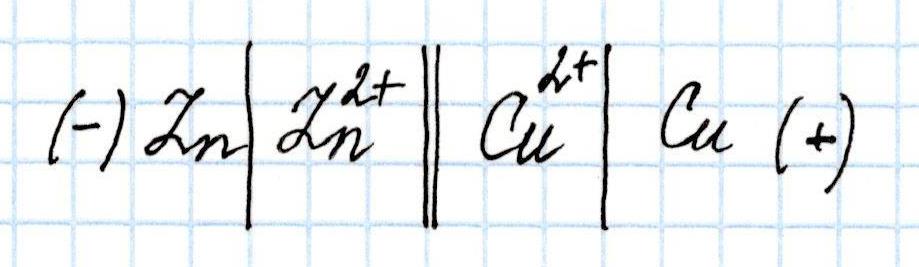
Для вычисления воспользуемся справочной таблицей стандартных электродных потенциалов металлов и формулой для расчета Э.Д.С., учитывая, что из двух значений потенциалов, меньшее будет соответствовать окислительным процессам на аноде, а большее – восстановительным процессам на катоде.
По данным таблицы восстановительный потенциал цинка равен -0,763 В. В данном процессе цинк окисляется, значит, его окислительный потенциал составляет +0,763 В. Медь восстанавливается, ее потенциал равен +0,337 В.
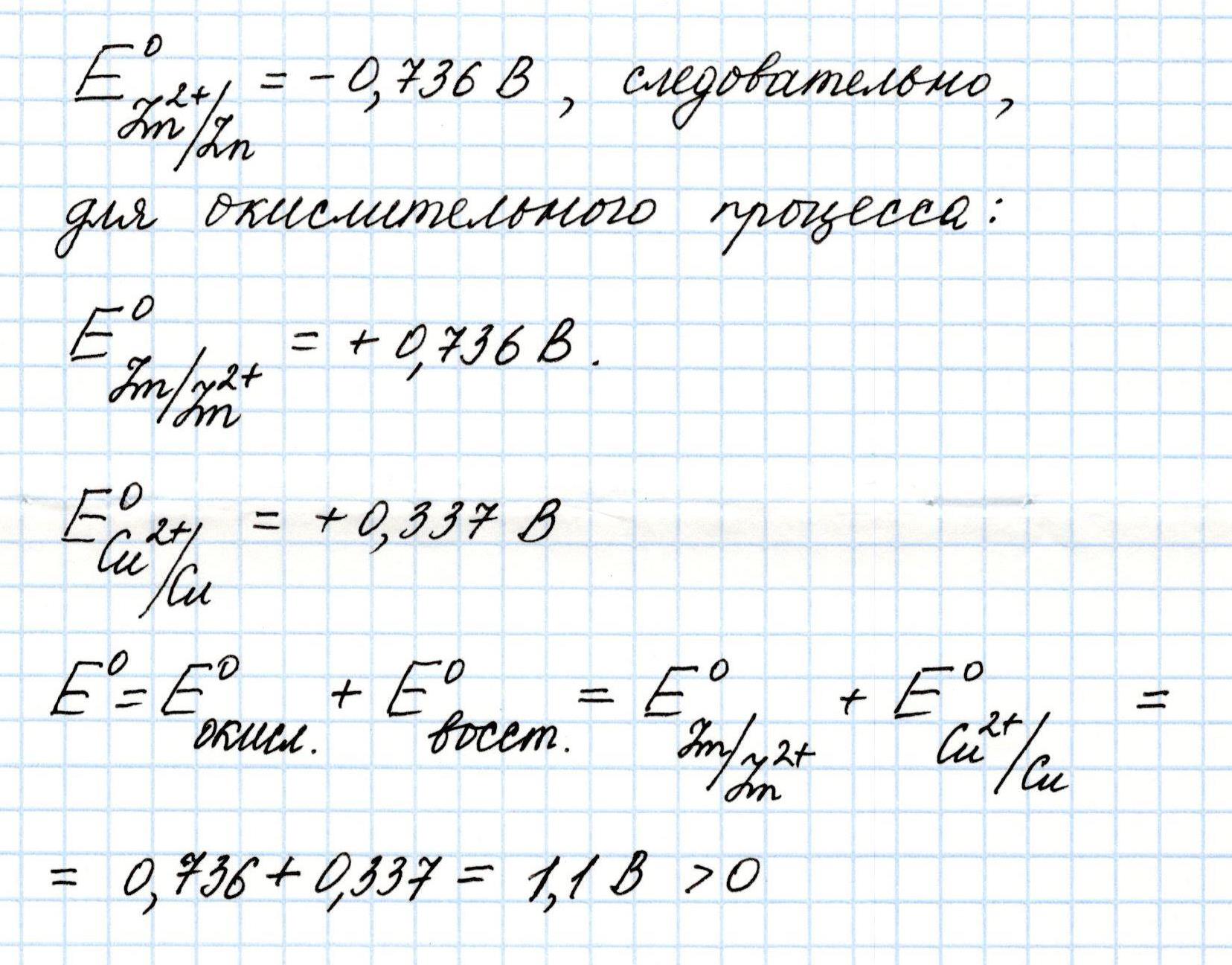
Ряд напряжений металлов. Что это такое и каково его значение
Если измерить указанным выше образом значения стандартных электродных потенциалов металлов и расположить их в порядке возрастания, то получится знаменитый ряд напряжений металлов (не совсем верный термин). Лучше его называть рядом стандартных электродных потенциалов металлов. Он имеет еще несколько названий: электрохимический ряд активности металлов, ряд Бекетова. В нем кроме металлов присутствует единственный неметалл водород. Надеемся, теперь понятно, почему.
Вот этот ряд:
Li Rb K Cs Ba Sr Ca Na Mg Be Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Cu Hg Ag Pt Au
Каково же значение данного ряда?
По величинам стандартных электродных потенциалов можно предположить, насколько ярко выражены те или иные свойства соответствующих металлов:
1) Чем меньше величина потенциала, тем более активным является металл. Так, ряд начинается литием. Величина его потенциала Е°=-3,045 В. Это самое маленькое значение среди всех остальных. И действительно, литий очень активный металл. Он легко окисляется и трудно восстанавливается из своего иона.
2) Все металлы, стоящие в данном ряду левее водорода (т.е. имеющие отрицательное значение потенциала) вытесняют его из разбавленных кислот (кислот, подобных соляной, серной).
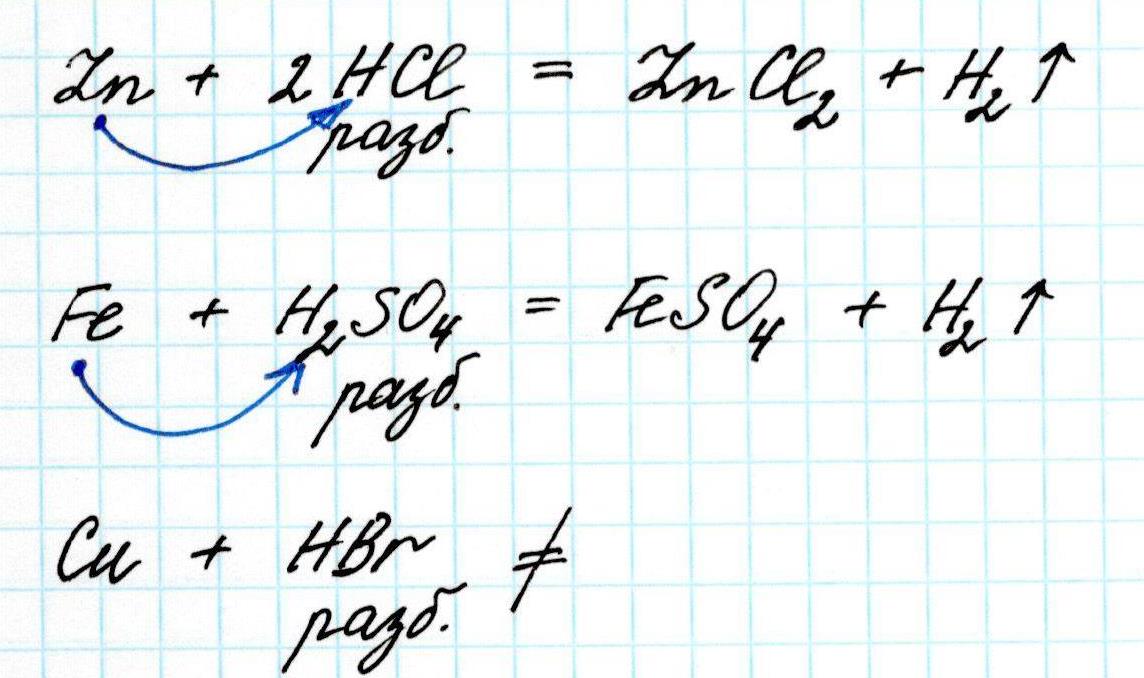
3) Каждый предыдущий металл ряда вытесняет все последующие из растворов их солей. Например:
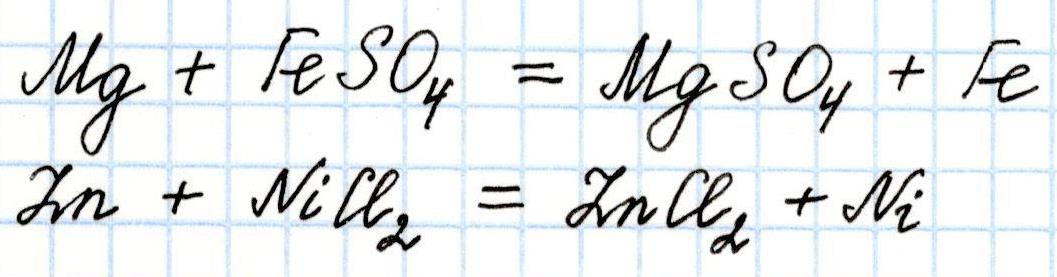
Этот вывод можно подтвердить расчетами:
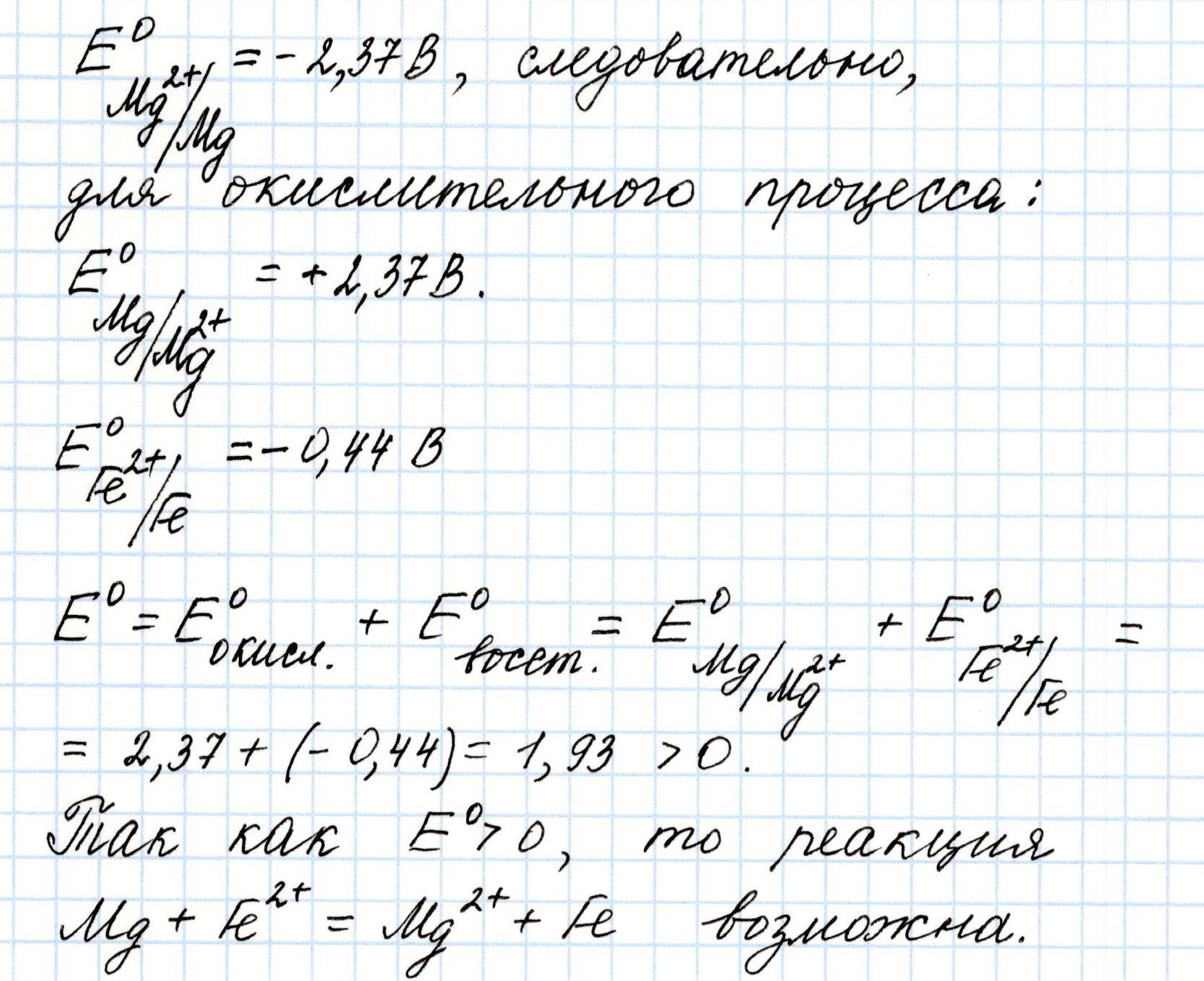
А вот такая реакция не возможна:
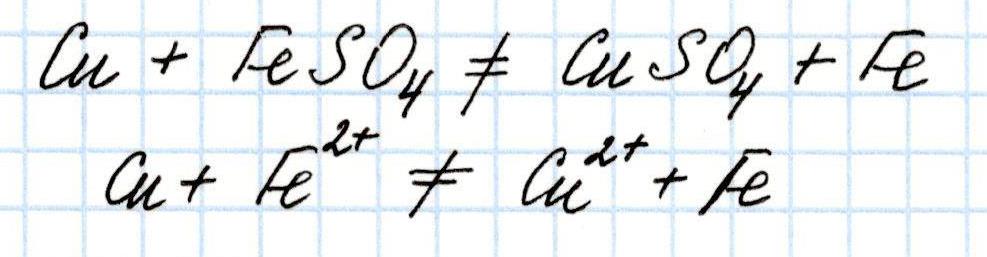
И это также легко подтверждается вычислением Э.Д.С. предполагаемого окислительно-восстановительного процесса:

Полученное отрицательное значение Э.Д.С. говорит о том, что переход электронов с меди на железо не возможен.
4) Если построить из металлов данного ряда гальванический элемент, то его Э.Д.С. будет тем больше, чем больше разность стандартных электродных потенциалов этих металлов.
Например, какой окислительно-восстановительный процесс будет идти эффективнее: вытеснение железа из его соли магнием или цинком? Для ответа на этот вопрос необходимо посчитать Э.Д.С. обоих процессов и сравнить полученные значения:
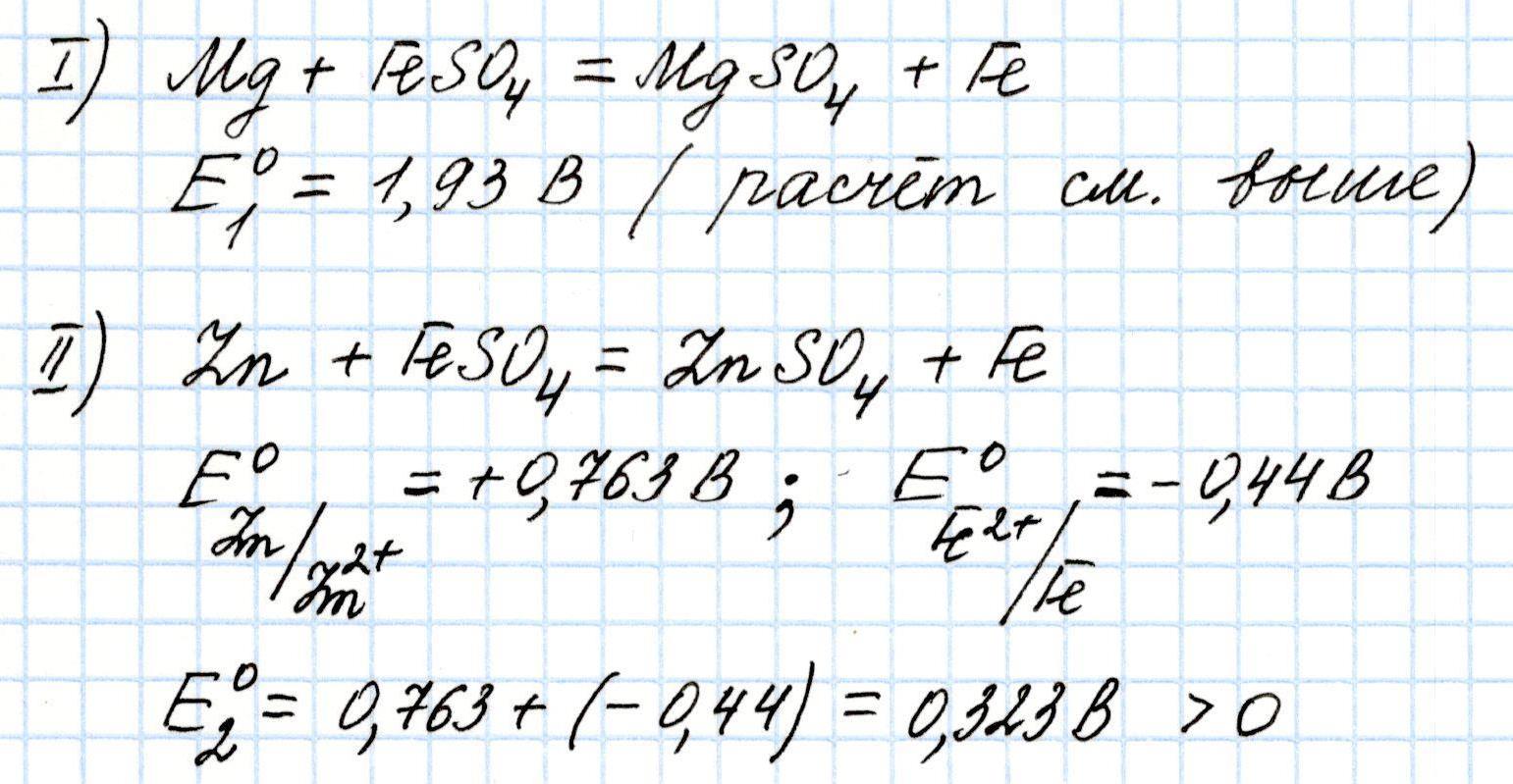
В обоих случаях Э.Д.С. положительна. Значит, процессы возможны. Однако, взаимодействие сульфата железа (II) с магнием более эффективно, чем с цинком почти в 6 раз.

Примеры вычислений Э.Д.С. гальванического элемента и электродных потенциалов
Разберем еще несколько примеров, в которых применяется формула, по которой определяется Э.Д.С. гальванического элемента.
Задача 1. Рассчитайте, будет ли протекать реакция при погружении пластинки железа в 1М раствор сульфата никеля.
Решение:
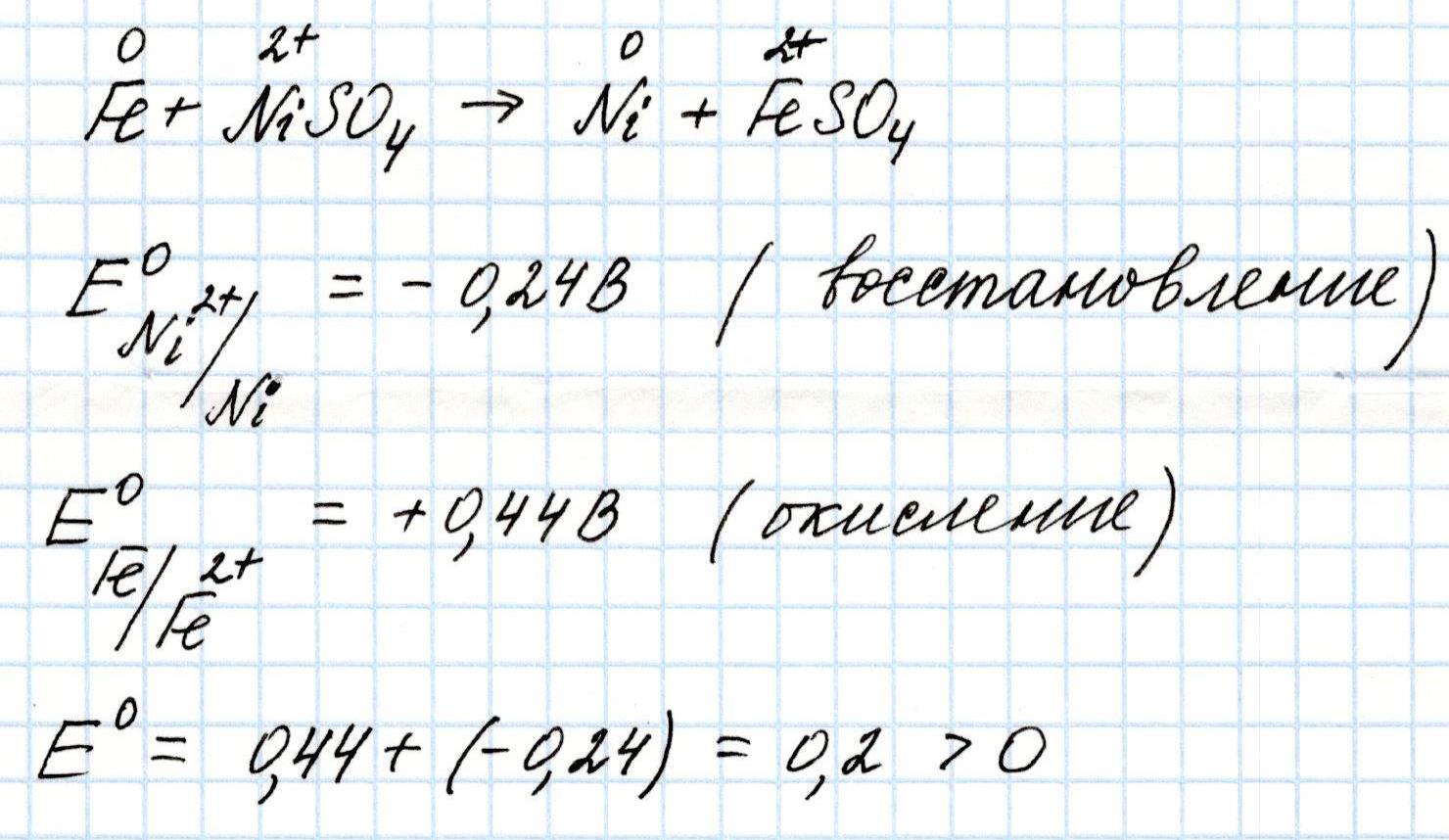
Так как значение Э.Д.С. предполагаемой окислительно-восстановительной реакции положительное, то такая реакция возможна.
Задача 2. Рассчитайте Э.Д.С., укажите направление движения электронов в имеющейся комбинации электродов:

Решение:
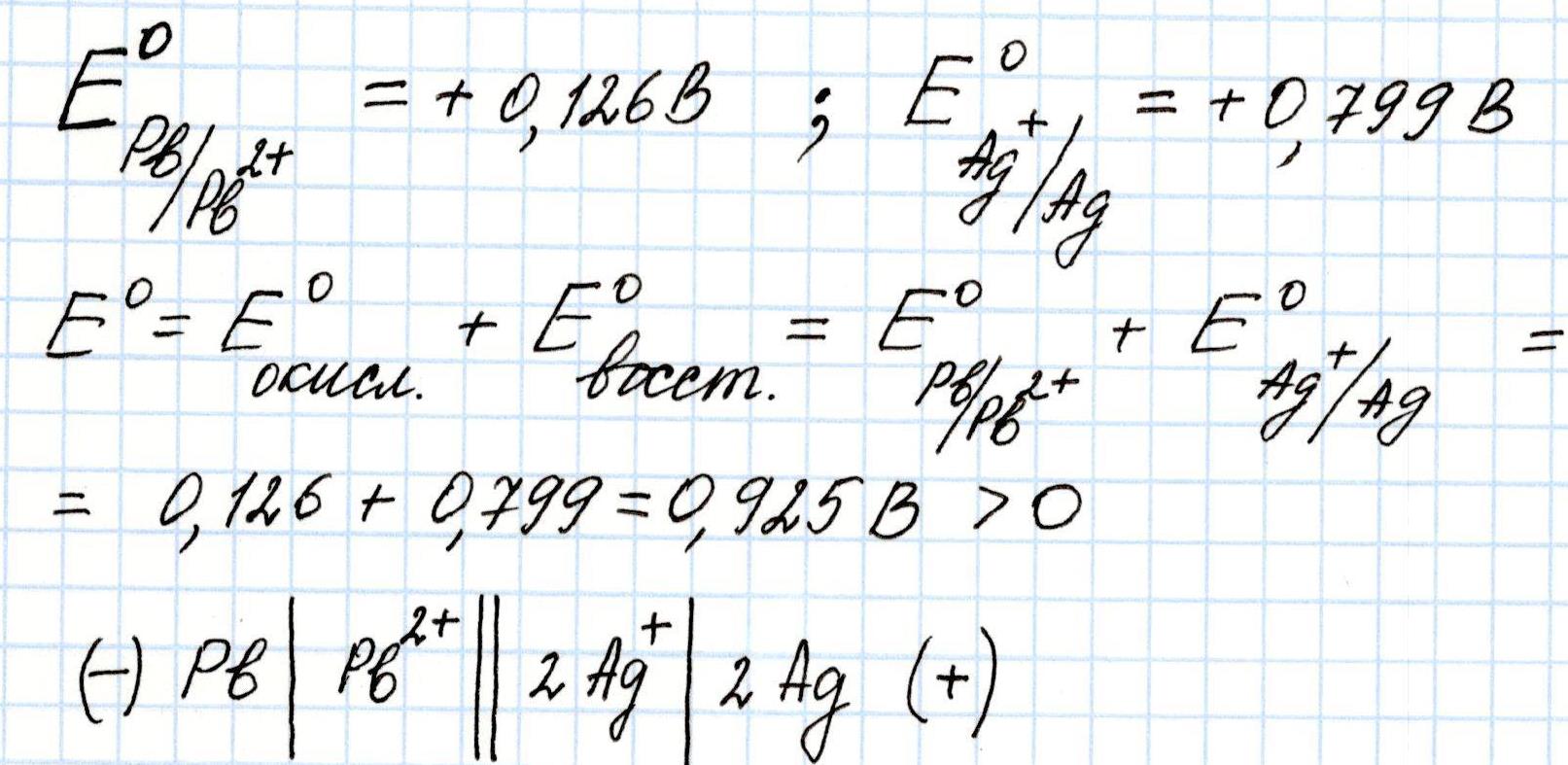
Окисляется свинцовый Pb анод, его электроны будут переходить на серебряный Ag катод.
Задача 3. Подтвердите расчетом, будет ли металлический никель растворяться: а) в 2М растворе серной кислоты; б) в растворе сульфата калия с той же активностью ионов.
Решение:
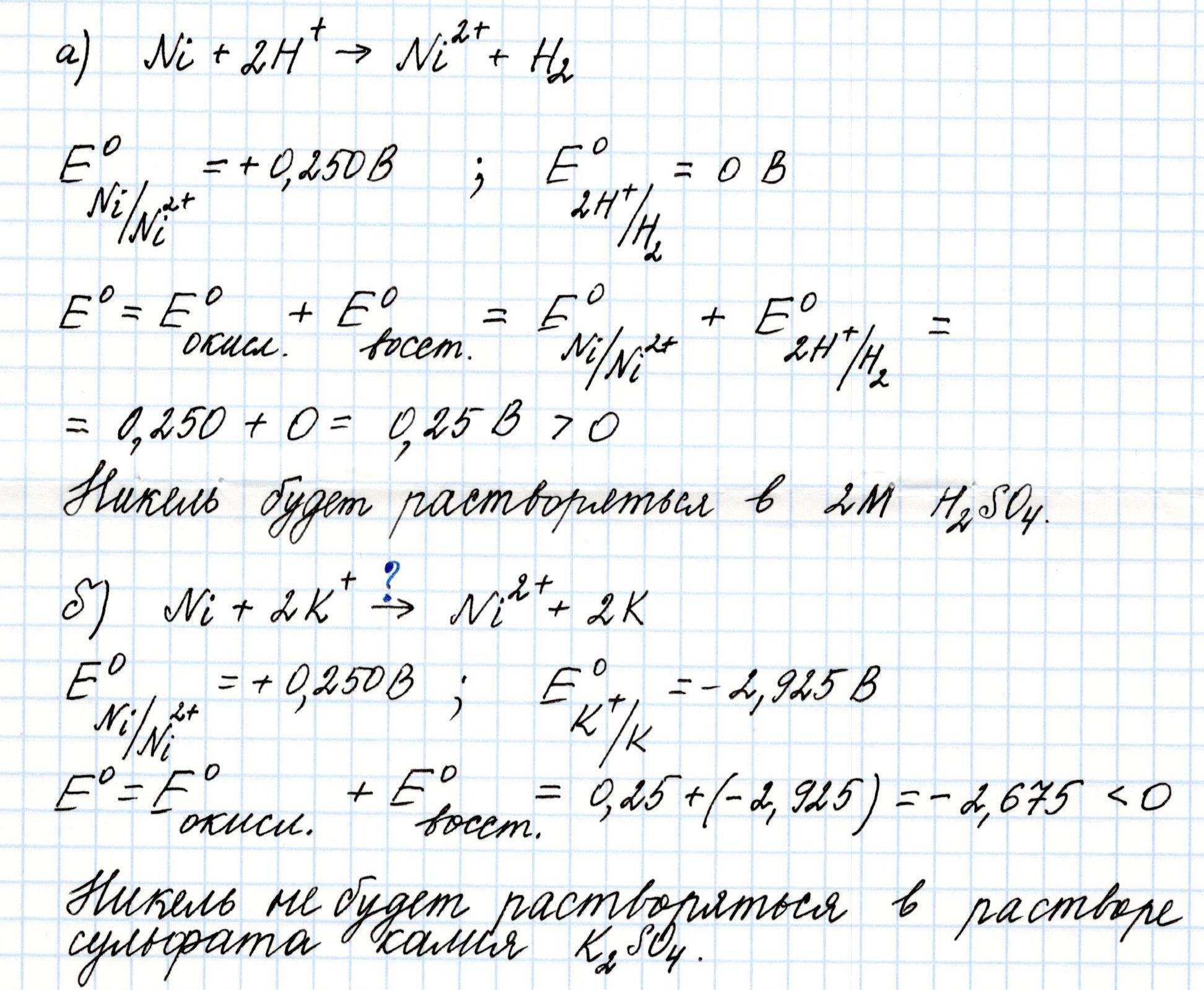
Задача 4. Определите возможность протекания в водном растворе реакции между хлором и хлоридом железа (II).
Решение:

Задача 5. Вычислите стандартную Э.Д.С. гальванического элемента, в котором протекает реакция:
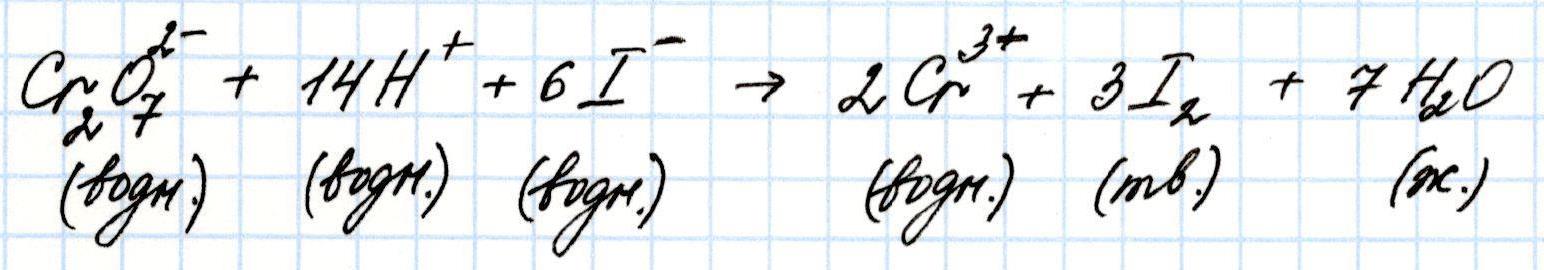
Решение:

Важный вывод из этой задачи:
значение Э.Д.С. гальванического элемента зависит от концентраций участников окислительно-восстановительного процесса, но не зависит от их количеств.
Количество вещества йода, которое мы умножили в окислительной полуреакции на три для соблюдения электронного баланса, не имеет значения, и поэтому величину стандартного электродного потенциала этой полуреакции на три умножать не нужно. Так же поступают во всех подобных случаях.
Таким образом, ЭДС гальванического элемента определяется по формуле, учитывающей значения стандартных электродных потенциалов. Она позволяет определить эффективность окислительно-восстановительного процесса, как в гальваническом элементе, так и при взаимодействии металла с раствором соли другого металла.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
 ХИМИЯ ДЛЯ ЧАЙНИКОВ
ХИМИЯ ДЛЯ ЧАЙНИКОВ